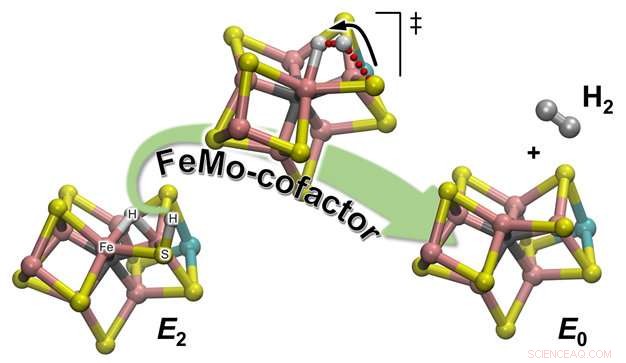
Ilustração esquemática de como H2 é formado a partir de um dos intermediários enzimáticos da reação (E2) para regenerar o estado de repouso (E0) do cofator catalítico da nitrogenase, chamado FeMo-cofator. O átomo de hidrogênio ligado a um dos átomos de enxofre inicia uma jornada que o levará ao encontro com o parceiro com o qual formará a molécula de H2:um hidrogênio hidrídico esperando pacientemente, sentado entre dois átomos de Fe. Crédito:Pacific Northwest National Laboratory
A nitrogenase é fundamental para a vida em nosso planeta. Ele fornece a maior parte do nitrogênio (N) que é usado em proteínas e ácidos nucléicos e é essencial na criação de plantas, animais e outros organismos, produzir amônia (NH3) que é então usada na biossíntese de aminoácidos e proteínas. Mas enquanto a nitrogenase está em ação, também está criando outra coisa:dihidrogênio (H2). Os cientistas sabem há algum tempo que a nitrogenase produz H2 por dois processos diferentes. Agora, um desses processos fica claro pelo trabalho de uma equipe de pesquisadores que estudou o mecanismo de produção de H2.
A nitrogenase produzirá H2 se executada na ausência de N2. Isso tem sido visto como um "relaxamento" do sítio ativo da enzima que é carregado com hidretos de ferro necessários para a reação de redução do N2. Mas qual é o mecanismo pelo qual os hidretos de ferro do sítio ativo da nitrogenase se relaxaram para formar esse H2? Uma equipe de cientistas do Pacific Northwest National Laboratory, Utah State University, Northwestern University, e a Universidade de Utah procurou entender esse mecanismo de relaxamento de H2 monitorando os efeitos do hidrogênio (H) versus deutério (D) na cinética de formação de H2 quando a nitrogenase é ligada a um eletrodo. A equipe descobriu que um H + próximo era na verdade o parceiro ativo na produção de H2 quando se combinava com o hidreto de ferro para formar H2.
"Apenas um próton faz tudo, o hidreto é apenas um mero espectador à espera de alguma ação, "confirmou Simone Raugei, um cientista PNNL envolvido neste trabalho.
Este é um passo importante para entender a nitrogenase e como e por que a produção de H2 é necessária para sua atividade. Também ilustra uma estratégia de estudo mecanístico que pode ser aplicada a outras enzimas oxidorredutase e a complexos biomiméticos.
Para isolar a cinética da produção de hidrogênio, uma equipe liderada por Lance Seefeldt, Brian Hoffman, Shelley Minteer, e Simone Raugei usou pequenas moléculas para transportar rapidamente elétrons de um eletrodo para a metade catalítica da nitrogenase. Seguir as reações do próton foi uma tarefa complicada e desafiadora, disse Seefeldt, portanto, para garantir a precisão, eles monitoraram o "inventário" de prótons (o número de hidrogênios envolvidos na produção catalítica de H2) realizando medições cinéticas de hidrogênio / deutério.
Os resultados dos experimentos sugeriram que apenas um hidrogênio estava realmente envolvido na etapa de limitação da taxa de formação de H2, e não dois como indica a estequiometria da reação.
As observações experimentais da equipe foram confirmadas por meio de química computacional, que forneceu uma descrição atomística detalhada do mecanismo de reação. Existem 2 tipos de hidrogênio no cofator catalítico (chamado FeMo-co):um localizado em uma posição de ponte onde se liga a dois átomos de ferro (um hidreto de ponte), e um em um ligante de átomo de enxofre próximo (basicamente um átomo de enxofre protonado:S-H). Acontece que durante a evolução H2, o último é o parceiro ativo. A ligação S-H se quebra e o H + resultante se move em direção ao hidreto em ponte e o protona formando H2:Os cálculos fornecem uma explicação da observação experimental de que apenas um hidrogênio está "ativo, “enquanto o outro é um mero espectador à espera da chegada do seu parceiro.
"O nível de concordância entre as observações e os resultados da química computacional foi extremamente alto, "disse Raugei.
Este trabalho é um passo crítico para uma compreensão mecanicista da enzima nitrogenase. Ainda há trabalho a ser feito para entender o mecanismo do outro processo de evolução de H2 que leva à ligação de N2, ativação, e redução para NH3.