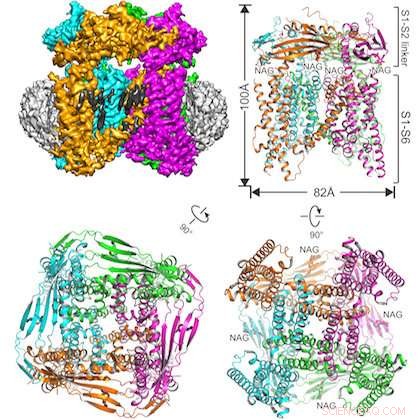
A ilustração mostra a proteína estudada incorporada em uma estrutura de nanodisco (canto superior esquerdo) e três visualizações do canal de íons TRPML1 de diferentes ângulos. Crédito:UT Southwestern
Pesquisadores do UT Southwestern Medical Center publicaram hoje uma estrutura atômica 3-D do canal iônico encontrada em mamíferos que está implicada em um raro, doença neurodegenerativa hereditária em humanos. O trabalho marca a primeira estrutura desse tipo determinada usando a instalação de microscopia crioeletrônica (crio-EM) de US $ 17 milhões da universidade, inaugurada no ano passado.
Em crio-EM, as amostras são rapidamente congeladas para evitar a formação de cristais de gelo prejudiciais e, em seguida, visualizadas a menos 321 graus Fahrenheit (temperaturas criogênicas). A instalação da UT Southwestern - que funciona 24 horas por dia - é uma das principais instalações do mundo para biologia estrutural crio-EM.
A equipe interdisciplinar resolveu a estrutura do canal de íons TRPML1 (potencial transiente do receptor mucolipina 1) do camundongo.
Seu estudo, publicado online por Natureza , acontece apenas uma semana depois de três desenvolvedores da tecnologia crio-EM serem reconhecidos com o Prêmio Nobel de Química de 2017 por seu trabalho nos instrumentos e metodologias que desencadearam a "revolução da resolução". O Cryo-EM permite visualizações em nível atômico de proteínas que resistem à cristalização necessária para a cristalografia de raios-X tradicional.
"Canais de íons em funcionamento são necessários para o movimento adequado de partículas eletricamente carregadas - íons - para dentro e para fora das células e organelas para executar processos celulares, "disse o Dr. Youxing Jiang, Professor de Fisiologia e Biofísica, um investigador do Howard Hughes Medical Institute (HHMI), e co-autoria do estudo.
O canal TRPML1, que regula o fluxo de íons de cálcio, é encontrado em todos os mamíferos. O canal fica na membrana das organelas dentro das células chamadas lisossomas, que contêm enzimas que auxiliam na reciclagem celular, quebrando grandes moléculas.
Cerca de 50 doenças de armazenamento lisossomal (LSDs) foram identificadas em humanos, incluindo uma classe de LSDs causados por mutações de perda de função em genes que governam os canais TRPML1. Este LSD, chamada mucolipidose tipo IV, é marcado por atraso no desenvolvimento de habilidades mentais e motoras e deficiência visual, de acordo com o National Institutes of Health.
"Devido à sua ligação com essa classe de doenças de armazenamento lisossomal, TRPML1 tem sido um alvo potencial para a terapêutica de pequenas moléculas e vários agonistas potenciais (abridores de canal) foram desenvolvidos, "disse o Dr. Jiang, a W.W. Caruth, Jr. Scholar in Biomedical Research. A determinação da estrutura de TRPML1 pode auxiliar na busca de tratamentos para mucolipidose tipo IV, ele disse.
As instalações de crio-EM da UT Southwestern abrigam três instrumentos de alta tecnologia, incluindo 12,5 metros de altura, Titan Krios de 2 toneladas que dispara um feixe de alta potência através de cada amostra, enquanto uma câmera especial captura imagens dos elétrons dispersos resultantes. Um braço robótico dentro da máquina pode segurar e mover com precisão uma dúzia de amostras congeladas por flash de maneira automatizada para que milhares de imagens possam ser gravadas, processado por meio de computadores, e interpretado para gerar imagens 3-D para estudo, os pesquisadores explicaram.

A equipe de pesquisa UTSW que determinou a estrutura atômica 3-D de um canal de íons inclui (linha inferior, da esquerda) drs. Youxing Jiang e Xiaochen Bai, e (linha superior, da esquerda) Jiangtao Guo, Quingfeng Chen, Weizhong Zeng, e Ji She. Crédito:UT Southwestern
Outra distinção neste estudo é o uso bem-sucedido de uma técnica de preparação de amostra relativamente nova:incorporar a proteína de interesse em uma estrutura de nanodisco feita de lipídios e outros materiais biológicos. Autor principal, Dr. Qingfeng Chen, um pesquisador de pós-doutorado no laboratório de Jiang, criou a amostra.
"Por muito tempo, detergente tem sido usado para extrair proteínas de membranas para estudo. As pessoas sugeriram que o detergente pode mudar a estrutura da proteína de seu estado nativo, "disse o Dr. Xiaochen Bai, um Professor Assistente de Biofísica e Biologia Celular e o segundo autor correspondente do estudo. "Proteínas de membrana, como aqueles que estudamos, são geralmente envoltos em lipídios. Nanodiscs são usados para fornecer um ambiente nativo para a amostra de proteína. "
Dr. Bai é especialista no software sofisticado usado para revelar a organização de átomos individuais dentro de cada partícula. Ele foi recrutado para a UT Southwestern como bolsista do Instituto de Pesquisa e Prevenção do Câncer do Texas (CPRIT) e bolsista Virginia Murchison Linthicum em Pesquisa Médica após cinco anos de treinamento no Laboratório MRC de Biologia Molecular em Cambridge, REINO UNIDO.
Trabalhando em uma equipe desenvolvendo o que se tornou um dos melhores programas de software para processar os dados de imagem gerados pela microscopia eletrônica, O Dr. Bai teve muitas conversas com o Dr. Richard Henderson, um dos três cientistas recebeu o Prêmio Nobel de Química na semana passada.
"Ele passou dia e noite no laboratório trabalhando no desenvolvimento de métodos para crio-EM. Uma de suas grandes contribuições foi o desenvolvimento de um novo tipo de câmera para tirar melhores fotos das proteínas estudadas com crio-EM, "Dr. Bai disse." Quando me mudei para a Inglaterra, ele me deu muita orientação e apoio e tivemos muitas discussões sobre técnicas de crio-EM. "