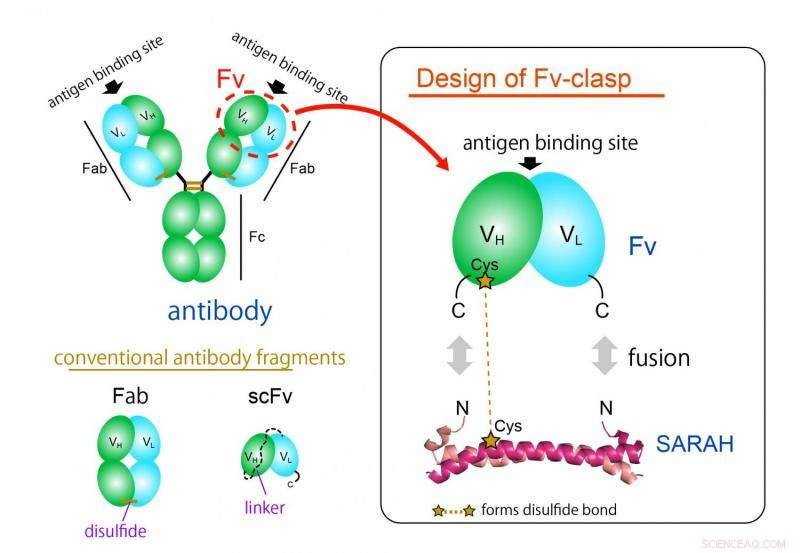
Figura 1. Conceito de design de um novo formato de fragmento de anticorpo “Fv-clasp”. Fv-clasp é uma fusão simples do domínio SARAH derivado da proteína Mst1 humana com o Fv (verde:cadeia pesada, ciano:fragmento de cadeia leve) de um anticorpo. O dímero VH / VL é estabilizado pela conformação do dímero do domínio SARAH (magenta claro e escuro). Crédito:Universidade de Osaka
Os anticorpos são um sistema de armas poderoso na defesa de nosso corpo contra invasores, como bactérias e vírus. Cada anticorpo consiste em quatro cadeias polipeptídicas de aminoácidos:duas cadeias pesadas e duas cadeias leves unidas para formar uma molécula em forma de Y. Os anticorpos reconhecem um antígeno específico único para seu alvo, pois possuem os locais de ligação ao antígeno localizados nas pontas superiores do Y. Embora a terapêutica baseada em anticorpos tenha sido estabelecida como drogas de primeira linha, pouco progresso foi feito no uso de anticorpos como ferramentas de pesquisa na descoberta de drogas de pequenas moléculas, particularmente no campo da cristalografia de raios-X.
A cristalografia de raios-X é uma técnica que usa padrões de difração de raios-X para determinar alta resolução, estruturas tridimensionais de moléculas, como proteínas, pequenas moléculas orgânicas, e materiais. O principal desafio nas abordagens de cristalografia de raios-X continua a ser a produção de cristais difratores de alta qualidade.
Nos últimos anos, existe um uso crescente de fragmentos de anticorpo como acompanhantes de cristalização para auxiliar na determinação estrutural de proteínas alvo de outra forma "não cristalizáveis" ou "não-remediaveis". A base para a estratégia é aumentar a probabilidade de obtenção de cristais bem ordenados, minimizando a heterogeneidade conformacional na proteína alvo.
O formato de fragmento de anticorpo mais comumente usado é o formato Fab, mas é difícil de produzir em sistemas de expressão bacteriana devido à sua estrutura grande e complexa. O fragmento Fv do anticorpo, que contém apenas uma cadeia pesada e uma cadeia leve, seria ideal para esta aplicação graças à sua arquitetura simples e pequena. Contudo, Fv raramente é usado porque as duas cadeias se dissociam facilmente, levando a uma perda de função.

Figura 2. Estrutura cristalina do fecho Fv. Estrutura tridimensional real do fecho Fv determinada por análise cristalográfica de raios-X. Crédito:Universidade de Osaka
Agora, uma equipe de pesquisadores da Universidade de Osaka projetou um novo fragmento Fv de cadeia única com compatibilidade de produção aprimorada, estabilidade e cristalização, enquanto mantém a capacidade de ligação da molécula original. Eles publicaram recentemente suas descobertas na Structure.
"Produzimos com sucesso um novo fragmento ao fundir uma estrutura em espiral anti-paralela derivada de um domínio particular de uma enzima humana, Mst1 quinase, aos locais de ligação ao antígeno de um anticorpo, "O autor principal do estudo, Takao Arimori, explica." A molécula quimérica resultante, Fv-clasp, era funcional e estruturalmente equivalente ao Fv do anticorpo original. "
Notavelmente, a mudança do formato Fab para Fv-clasp aumentou significativamente a cristalização assistida por anticorpo de duas proteínas biologicamente importantes, os domínios extracelulares integrina a6b1 e sorLasorLA. A integrina a6b1 desempenha um papel significativo na fixação de células iPS e células ES, bem como de muitas células cancerosas do fígado à membrana basal, uma base de rede de proteína extracelular presente nos tecidos da maioria das células e órgãos, enquanto sorLA é o receptor de proteína implicado na doença de Alzheimer.
"A aplicabilidade universal do design Fv-clasp para produção em grande escala e barata torna-o desejável para aplicações industriais. Além disso, sua alta estabilidade ao calor é uma grande vantagem para imunoterapias, "diz o autor correspondente Junichi Takagi." Além do campo da biologia estrutural, prevemos que o projeto Fv-clasp contribuirá para a expansão do uso de anticorpos já eminentes nas ciências básicas e aplicadas. "