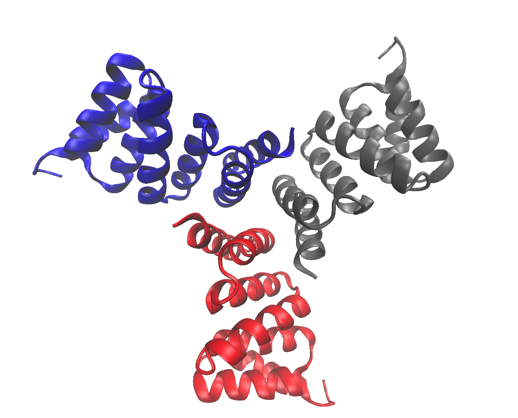
A estrutura cristalina de alta resolução de uma das proteínas estudadas, um trímero projetado computacionalmente. A estrutura foi depositada no Protein Data Bank com o número de acesso 5HRZ. Crédito:Laboratório Nacional Lawrence Berkeley
As proteínas cíclicas que se agrupam a partir de várias subunidades idênticas (homo-oligômeros) desempenham papéis importantes em muitos processos biológicos, incluindo sinalização celular e catálise enzimática e função de proteína. Pesquisadores da Divisão de Biofísica Molecular e Bioimagem Integrada (MBIB) do Berkeley Lab trabalharam com David Baker da Universidade de Washington, que liderou uma equipe para projetar in silico e cristalizar proteínas homo-oligoméricas cíclicas de automontagem.
Ao prever e projetar esses oligômeros de ordem superior, Baker e sua equipe ganharam uma compreensão dos princípios fundamentais subjacentes às interações oligômero-oligômero. Além das interações internas da própria proteína, esses oligômeros projetados podem ser usados para explorar questões básicas sobre como a estrutura das moléculas de sinalização afeta o comportamento dos receptores e a resposta celular.
Uma estratégia foi desenvolvida para projetar interfaces em proteínas idealizadas com o objetivo de direcionar sua montagem em complexos multiméricos. Os pesquisadores do Berkeley Lab usaram caracterização estrutural - cristalografia de raios-X e espalhamento de raios-X de pequeno ângulo (SAXS) - para mostrar que muitos dos projetos adotaram o estado de oligomerização alvo e a estrutura prevista. Seu trabalho não apenas demonstra que os cientistas têm uma compreensão básica do que determina a oligomerização, também mostra que eles podem projetar proteínas com formato ajustável, Tamanho, e simetria para uma variedade de aplicações biológicas.
Alguns dos trabalhos de cristalografia de raios-X incluídos no artigo foram realizados sob os auspícios do programa Coletivo de Cristalografia, que é dirigido pelo cientista pesquisador Banumathi Sankaran na Advanced Light Source. O colega pesquisador Henrique Pereira cristalizou as proteínas projetadas por pesquisadores da Universidade de Washington. Sankaran e Peter Zwart, Cientista da equipe do MBIB, coletou dados cristalográficos no Beamline 5.0.2 no Berkeley Center for Structural Biology e resolveu as estruturas. Para obter informações sobre a dinâmica da proteína projetada, Kathryn Burnett e Greg Hura da MBIB executaram SAXS na linha de luz SIBYLS.
Pereira, Sankaran, e Zwart foram co-autores em vários artigos com Baker e sua equipe, todos os quais seguem um tema de projeto de proteína e validação de estrutura.
"Os homo-oligômeros cíclicos desempenham papéis importantes na função biológica, "disse Sankaran." Aqui temos outro projeto sintético que foi comprovado para corresponder ao projeto computacional com estudos de solução de pequeno ângulo e espalhamento de raios-X. "
Este trabalho, junto com a folha beta curva e designs de metaloproteína trimérica, alargar as possibilidades de desenvolvimento de novas terapêuticas e biomateriais.