Crédito:American Chemical Society
As transfusões de sangue podem salvar a vida de pacientes que sofreram grandes perdas de sangue, mas os hospitais nem sempre têm o suficiente ou o tipo certo em mãos. Em busca de uma solução, pesquisadores desenvolveram um substituto promissor usando o componente de transporte de oxigênio do sangue, hemoglobina. O estudo in vitro, relatado no jornal ACS Biomacromoléculas , descobriram que a hemoglobina modificada era um transportador de oxigênio eficaz e também eliminava os radicais livres potencialmente prejudiciais.
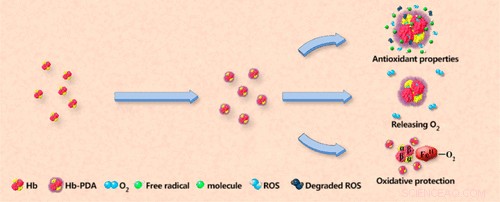
Os glóbulos vermelhos são o componente do sangue mais comumente transfundido, de acordo com o U.S. National Heart, Pulmão, e Instituto de Sangue. Essas células carregam a proteína hemoglobina, que desempenha a função essencial de fornecer oxigênio aos tecidos do corpo. Cientistas tentaram desenvolver hemoglobina quimicamente modificada - que por si só é tóxica - como um substituto do sangue, mas descobriram que ela forma metemoglobina. Essa forma da proteína não se liga ao oxigênio e, portanto, diminui a quantidade de oxigênio que o sangue fornece ao corpo. Além disso, a geração de metemoglobina produz peróxido de hidrogênio, o que leva a danos celulares. Hong Zhou, Lian Zhao, Yan Wu e seus colegas queriam ver se a embalagem da hemoglobina em um envelope benigno poderia contornar esses problemas.
Os pesquisadores desenvolveram um método de uma etapa para envolver a hemoglobina em polidopamina, ou PDA, que tem sido amplamente estudado para aplicações biomédicas. Uma bateria de testes de laboratório mostrou que a hemoglobina revestida com PDA efetivamente transportava oxigênio, enquanto evita a formação de metemoglobina e peróxido de hidrogênio. Além disso, causou danos celulares mínimos, e atuou como um antioxidante eficaz, catando radicais livres potencialmente prejudiciais e espécies reativas de oxigênio.