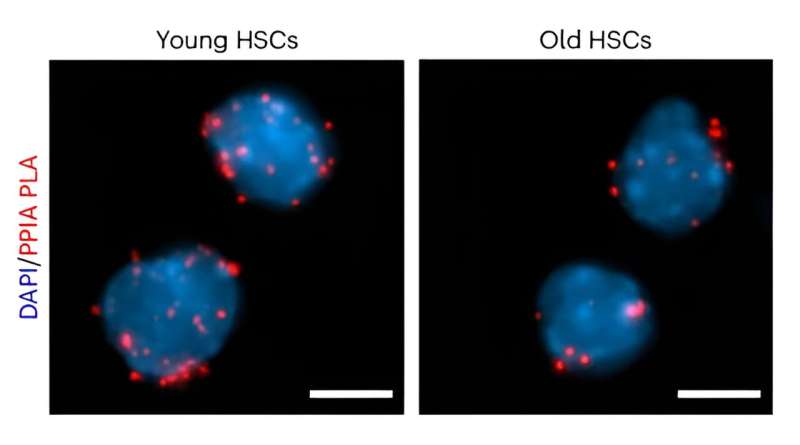
 Os níveis de ciclofilina A, mostrados aqui em vermelho, diminuem à medida que as células-tronco hematopoiéticas envelhecem. Crédito:Nature Cell Biology (2024). DOI:10.1038/s41556-024-01387-x
Os níveis de ciclofilina A, mostrados aqui em vermelho, diminuem à medida que as células-tronco hematopoiéticas envelhecem. Crédito:Nature Cell Biology (2024). DOI:10.1038/s41556-024-01387-x Nada vive para sempre, mas em comparação com outras células do corpo, as células-tronco hematopoiéticas (HSCs) têm vida extraordinariamente longa. As HSC são células formadoras de sangue – dão origem a células progenitoras que se dividem rapidamente, que por sua vez geram centenas de milhares de milhões de células para satisfazer a procura diária de glóbulos vermelhos que fornecem oxigénio, glóbulos brancos que combatem doenças e plaquetas formadoras de coágulos.
As HSCs normalmente permanecem latentes na medula óssea, mas possuem a capacidade de ativar e repor células sanguíneas continuamente, mantendo um perfil relativamente jovem ao longo da vida de um organismo. Qual é o segredo das HSCs de longa duração que afastam os efeitos do envelhecimento? Uma equipe liderada por pesquisadores do Baylor College of Medicine revelou na Nature Cell Biology que a enzima ciclofilina A, produzida em grandes quantidades nas HSCs, é fundamental para que essas células mantenham seu potencial regenerativo e evitem os efeitos do envelhecimento.
Viva as células-tronco
“Uma força motriz do envelhecimento celular é o acúmulo de proteínas que atingiram o fim de sua vida útil”, disse o autor correspondente, Dr. André Catic, professor assistente e bolsista CPRIT em Pesquisa do Câncer no Huffington Center on Aging em Baylor. “Com a idade, as proteínas tendem a se dobrar, agregar e acumular dentro da célula, o que leva ao estresse tóxico que pode perturbar a função celular”.
As células que frequentemente se envolvem na divisão celular, como as células progenitoras, podem eliminar agregados proteicos por meio de diluição. Por outro lado, as HSCs de vida longa, que não se dividem frequentemente, enfrentam o problema da acumulação de proteínas mal dobradas e subsequente stress tóxico. No entanto, os HSCs permanecem imunes ao envelhecimento. Como eles fazem isso?
"Compreender os mecanismos moleculares que contribuem para o envelhecimento do HSC não só contribui para o campo da biologia normal do HSC, mas também pode ter relevância clínica significativa para o tratamento do câncer", disse a coautora do trabalho, Dra. o laboratório Catic enquanto trabalhava neste projeto.
Acompanhantes moleculares em ação
Estudos anteriores mostraram que as células de mamíferos expressam várias centenas de acompanhantes moleculares, proteínas que preservam ou alteram a conformação tridimensional das proteínas existentes. As ciclofilinas, uma das chaperonas mais abundantes, têm sido implicadas no processo de envelhecimento. No entanto, a forma como afectam as proteínas celulares não foi previamente estudada.
Trabalhando com ratos, os pesquisadores primeiro caracterizaram o conteúdo proteico das HSCs e descobriram que a ciclofilina A é um acompanhante predominante. Outras experiências mostraram que a expressão da ciclofilina A foi significativamente diminuída em HSCs envelhecidas, e a eliminação genética da ciclofilina A acelerou o envelhecimento natural no compartimento das células-tronco. Em contraste, a reintrodução da ciclofilina A em HSCs envelhecidas melhorou a sua função. Juntas, essas descobertas apoiam a ciclofilina A como um fator chave na longevidade das HSCs.
Conectando ciclofilina A, proteínas intrinsecamente desordenadas e longevidade de HSC
Em seguida, a equipe investigou as proteínas com as quais a ciclofilina A interage, preservando sua estabilidade. “Descobrimos que proteínas enriquecidas em regiões intrinsecamente desordenadas são alvos frequentes do acompanhante”, disse Catic.
Proteínas intrinsecamente desordenadas mudam naturalmente sua conformação 3D para interagir com diferentes proteínas, ácidos nucléicos ou outras moléculas. Consequentemente, proteínas ricas em regiões intrinsecamente desordenadas regulam muitos processos celulares, promovendo atividades específicas entre moléculas.
"Devido à sua natureza flexível, as proteínas intrinsecamente desordenadas são inerentemente propensas à agregação. A ciclofilina A apoia estas proteínas no cumprimento das suas funções e, simultaneamente, impede-as de se aglomerarem", disse Catic.
Além disso, os resultados sugerem que a ciclofilina A interage com proteínas intrinsecamente desordenadas desde o momento da sua síntese. “À medida que essas proteínas são produzidas, a ciclofilina A garante que elas mantenham as conformações apropriadas e sejam mantidas em níveis suficientes”, disse Catic. "A depleção genética da ciclofilina A resulta em células-tronco claramente desprovidas de proteínas intrinsecamente desordenadas."
“Pela primeira vez, o nosso estudo mostrou que a produção de proteínas desordenadas e a manutenção da diversidade estrutural das proteínas numa célula desempenham um papel no envelhecimento das HSC”, disse Maneix.
Co-autor Polina Iakova, Charles G. Lee, Shannon E. Moree, Xuan Lu, Gandhar K. Datar, Cedric T. Hill, Eric Spooner, Jordon C. K. King, David B. Sykes, Borja Saez, Bruno Di Stefano, Xi Chen, Daniela S. Krause, Ergun Sahin, Francis T. F. Tsai, Margaret A. Goodell, Bradford C. Berk e David T. Scadden também contribuíram para este estudo.
