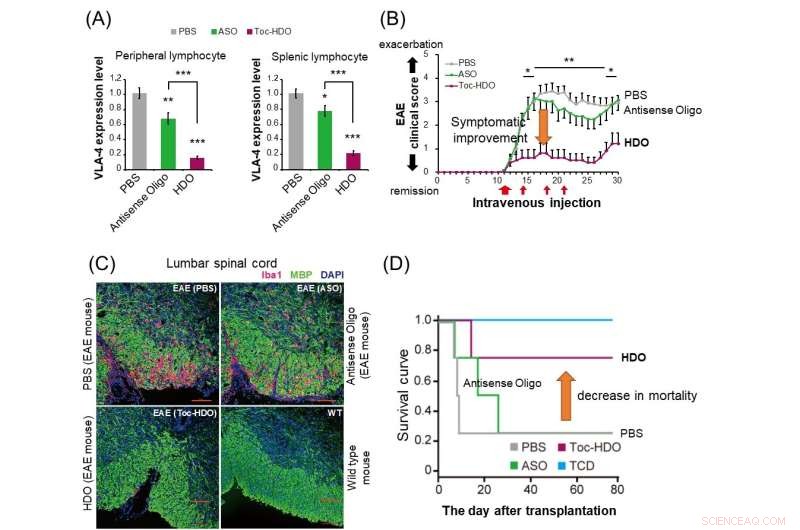
(A) Em camundongos normais, a administração de HDO (barra vermelha) suprime mais drasticamente a expressão do gene da integrina α4β1 em linfócitos periféricos e esplênicos em comparação com oligonucleotídeo antisense (barra verde). (B) Em camundongos com encefalomielite autoimune experimental (EAE), a administração de HDO visando integrina α4β1 após o início dos sintomas mostrou melhora no escore clínico. (C) A administração de HDO visando a integrina α4β1 antes do início de camundongos EAE resulta na redução da infiltração de células inflamatórias positivas para Iba1 (vermelho) e desmielinização melhorada (verde) na medula espinhal lombar. (D) No modelo de camundongo de enxerto versus -doença do hospedeiro (GVHD), transplante de células T derivadas do baço juntamente com células da medula óssea após tratamento com HDO visando integrina α4β1 melhorou a curva de sobrevivência. TCD:Células de medula óssea transplantadas sem células T derivadas do baço. Crédito:Departamento de Neurologia e Ciências Neurológicas, TMDU
Os linfócitos T e B, que fazem parte de um grupo de células imunes comumente chamadas de glóbulos brancos, trabalham juntos para eliminar invasores estranhos no corpo, como vírus. No entanto, certas doenças podem surgir quando as células T e B são ativadas em momentos inadequados, incluindo distúrbios autoimunes e vários tipos de câncer. Em um artigo recente publicado na
Nature Communications , uma equipe liderada por pesquisadores da Tokyo Medical and Dental University (TMDU) descreve uma tecnologia chamada oligonucleotídeo heteroduplex (HDO) que eles desenvolveram para entregar aos linfócitos e regular suas funções.
A expressão gênica está na raiz do controle da atividade celular. A doença pode ocorrer quando certos genes são desligados inadequadamente ou são expressos de forma incontrolável. Portanto, os cientistas têm como objetivo desenvolver métodos terapêuticos para restaurar os níveis de expressão gênica ao seu estado saudável, idealmente apenas nas células anormais. Uma dessas modalidades é fornecer moléculas de DNA ou RNA especificamente projetadas que podem localizar as mensagens genéticas mal expressas e direcionar a célula para reduzi-las de volta aos níveis normais. No entanto, a parte mais difícil disso é garantir que as moléculas terapêuticas possam chegar com eficiência ao seu destino adequado sem serem degradadas pela célula.
“Nossa equipe projetou uma molécula híbrida de DNA/RNA chamada HDO”, diz o principal autor do estudo, Masaki Ohyagi. "A sequência específica do HDO pode ser alterada para atingir um gene específico de interesse, enquanto sua espinha dorsal o torna estável dentro das células".
Uma parte fundamental do projeto HDO da equipe é a adição de uma molécula chamada α-tocoferol, que é crucial para sua entrega adequada. Como o α-tocoferol é essencial para respostas imunes linfocíticas adequadas, a adição disso permite que o HDO seja entregue no sangue periférico e direcionado aos linfócitos. A equipe projetou HDOs para vários genes de camundongos e depois os injetou intravenosamente em camundongos de laboratório.
“Descobrimos que nossa tecnologia HDO foi capaz de silenciar especificamente esses genes em linfócitos de camundongos de forma mais robusta e estável, e também com menos toxicidade, do que outras versões anteriores desse método”, afirma Takanori Yokota, autor sênior do artigo. "Nossos estudos também mostraram que os HDOs entram nessas células por meio de um processo chamado endocitose".
Depois de descobrir que sua tecnologia era eficaz no silenciamento de genes, a equipe da TMDU investigou se poderia ser útil como tratamento de doenças. Eles projetaram um HDO visando um gene chamado Itga4, que é central para a patogênese da encefalomielite autoimune experimental (EAE), um modelo de camundongo para esclerose múltipla (EM).
"A injeção intravenosa desses camundongos com um HDO direcionado a Itga4 atrasou o início e melhorou os sintomas de EAE e reduziu a infiltração de células inflamatórias e a desmielinização da medula espinhal", explica Ohyagi.
Este trabalho demonstra os poderosos efeitos de silenciamento de genes da tecnologia HDO, bem como suas capacidades de entrega superiores em relação a outros métodos semelhantes. Mais significativamente, o HDO específico de Itga4 foi capaz de melhorar os resultados em um modelo de camundongo com EM, sugerindo que pode ser útil como uma nova terapêutica que pode ser desenvolvida para doenças imunomediadas humanas.
