Resumo gráfico. Crédito:Biologia Atual (2022). DOI:10.1016/j.cub.2022.05.021
Durante os últimos anos, o CRISPR ganhou as manchetes por ajudar a tratar pacientes com condições tão variadas quanto cegueira e doença falciforme. No entanto, muito antes de os humanos cooptarem o CRISPR para combater distúrbios genéticos, as bactérias estavam usando o CRISPR como um sistema imunológico para combater os vírus.
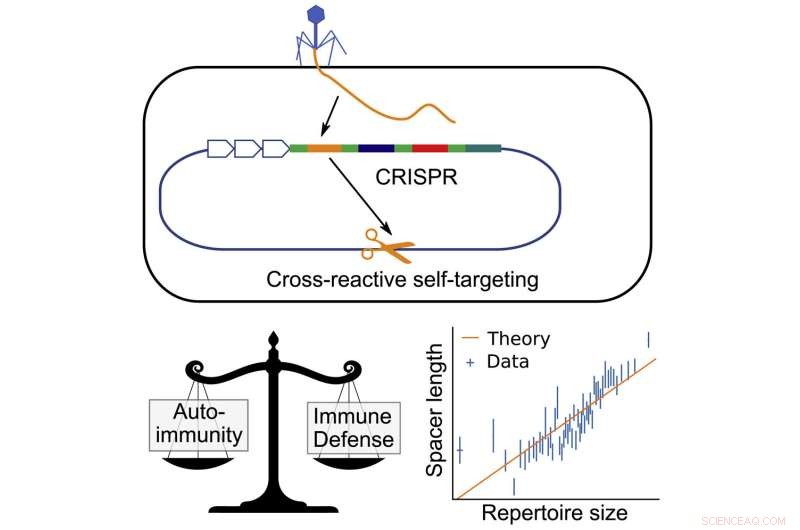
Em bactérias, CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) funciona roubando pequenos pedaços de DNA de vírus infectantes e armazenando esses pedaços nos genes das bactérias. Esses pedaços de DNA, chamados espaçadores, são então copiados para formar pequenas etiquetas, que se ligam a proteínas que flutuam até encontrar um pedaço de DNA correspondente. Quando encontram uma correspondência, reconhecem-no como um vírus e o cortam.
Agora, um artigo publicado na
Current Biology por pesquisadores do Departamento de Física e Astronomia da Universidade da Pensilvânia mostra que o risco de autoimunidade desempenha um papel fundamental na forma como o CRISPR armazena informações virais, orientando quantos espaçadores as bactérias mantêm em seus genes e quanto tempo esses espaçadores são.
Idealmente, os espaçadores devem corresponder apenas ao DNA pertencente ao vírus, mas há uma pequena chance estatística de que o espaçador corresponda a outro pedaço de DNA da própria bactéria. Isso pode significar a morte por uma resposta autoimune.
"O sistema imunológico adaptativo em vertebrados pode produzir distúrbios autoimunes. Eles são muito sérios e perigosos, mas as pessoas não consideraram isso com cuidado para as bactérias", diz Vijay Balasubramanian, pesquisador principal do artigo e Cathy e Marc Lasry Professor de Física na Escola de Artes e Ciências.
Equilibrar esse risco pode colocar as bactérias em uma espécie de vínculo evolutivo. Ter mais espaçadores significa que eles podem armazenar mais informações e afastar mais tipos de vírus, mas também aumenta a probabilidade de um dos espaçadores corresponder ao DNA da bactéria e desencadear uma resposta autoimune.
Balasubramanian, juntamente com os coautores Hanrong Chen, do Genome Institute of Singapore, e Andreas Mayer, da University College London, perceberam que as bactérias poderiam contornar isso com espaçadores mais longos. Semelhante a como uma senha mais longa pode ser mais difícil de decifrar, um espaçador mais longo teria menos probabilidade de corresponder ao DNA da própria bactéria. Isso significa que bactérias com espaçadores mais longos poderiam ter mais espaçadores em geral sem o risco de desencadear uma resposta autoimune.
Com essa ideia em mãos, os pesquisadores construíram um modelo matemático para calcular a razão entre o comprimento do espaçador e o número total de espaçadores que a bactéria deveria ser capaz de armazenar sem arriscar uma resposta autoimune.
Depois de elaborar o modelo matemático, eles verificaram se sua previsão era verdadeira em bactérias reais, observando o DNA CRISPR de milhares de espécies e comparando o comprimento do espaçador com o número de espaçadores armazenados.
Os pesquisadores encontraram uma relação consistente e estreita entre o comprimento do espaçador e o número de espaçadores.
"A surpresa para mim é que combinou tão bem assim que saiu da caixa", diz Balasubramanian. "Esta é uma estrutura teórica muito simples. Há um risco de autoimunidade, mas é bom ter mais memória imunológica, e você deve equilibrar essas duas considerações. É muito, muito raro que algo tão simples corresponda aos dados."
Balasubramanian diz que o sucesso do modelo mostra que essa estrutura de trocas matemáticas simples pode se aplicar a sistemas mais complexos, como o sistema imunológico de vertebrados, incluindo humanos.
"Apenas fazendo esse tipo de raciocínio estatístico, você pode fazer muito progresso", diz ele. "Então, talvez possamos voltar à imunidade dos vertebrados e usar as mesmas técnicas."
Este estudo também está entre os primeiros a descrever a importância da resposta autoimune em bactérias. Balasubramanian e seus colaboradores esperam que futuros estudos do CRISPR considerem o risco de autoimunidade.
Quanto ao trabalho futuro em seu grupo, ele pretende explorar como o CRISPR armazena informações em resposta a vírus em evolução. E embora um modelo estatístico de genes bacterianos em evolução possa parecer muito distante da vida cotidiana, Balasubramanian diz que este trabalho estabelece uma base para uma compreensão mais ampla da imunidade, de maneiras que podem permitir uma visão mais profunda de vírus como a gripe sazonal ou o novo SARS-CoV -2 variantes.
Diz Balasubramanian:"Estas são todas as peças de um quebra-cabeça maior."
