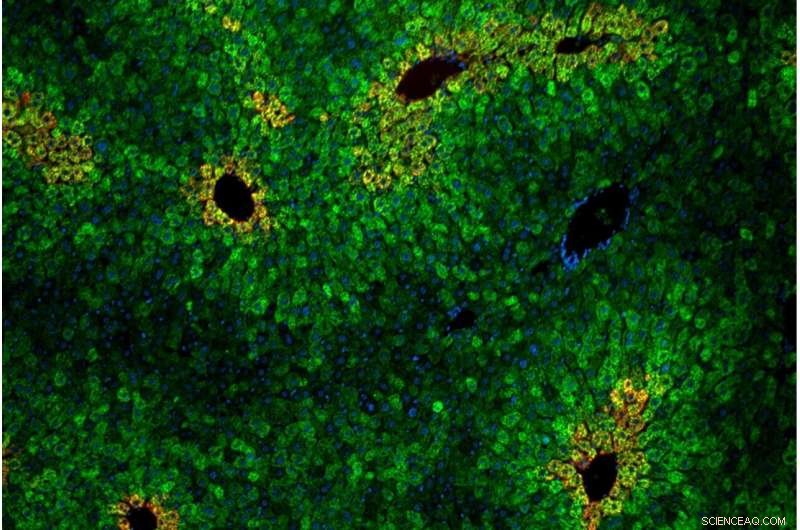
As células do fígado estão dispostas em “lóbulos” de anéis concêntricos de hepatócitos. As células hepáticas dentro dos lóbulos variam em sua sensibilidade ao aminoácido essencial leucina. Crédito Andrew Cangelosi/Instituto Whitehead
Um novo artigo de pesquisadores do Instituto Whitehead revela como os ratos sentem um aminoácido essencial chamado leucina, que muitas pessoas obtêm ao comer peixe, ovos ou nozes. Mais adiante, o trabalho pode informar pesquisas sobre a criação de medicamentos que visam partes específicas de uma via metabólica e reguladora de crescimento chave chamada via mTOR para tratar alguns tipos de câncer ou outras doenças metabólicas.
A leucina é necessária para construir e reparar os músculos do corpo; se o corpo não puder acessar esse aminoácido a partir dos alimentos, seu melhor curso de ação é desligar o metabolismo em certos tecidos até que o recurso seja restaurado. É por isso que a detecção de leucina é importante – se o metabolismo do animal continuar funcionando normalmente sem a leucina, os pesquisadores descobriram que o animal essencialmente se canibaliza, esgotando as reservas de gordura e músculo.
O ex-pesquisador do Instituto Whitehead, Andrew Cangelosi, liderou o estudo enquanto completava seu doutorado. no laboratório do ex-membro do Instituto Whitehead, David Sabatini. "As pessoas sabem há muito tempo que os aminoácidos regulam muito fortemente a via mTOR, mas quando comecei no laboratório, era uma grande caixa preta - estávamos apenas começando a entender o que eles estavam fazendo e como isso estava acontecendo". disse Cangelosi.
Nos últimos 15 anos, pesquisadores – do Whitehead Institute e de outros lugares – desvendaram alguns dos mecanismos de como os aminoácidos afetam a via. "Um dos grandes insights que vieram disso foi que o caminho se preocupava com aminoácidos muito específicos", disse Cangelosi. Existem 20 aminoácidos usados por células de mamíferos para criar proteínas, e alguns deles – incluindo leucina – têm um efeito muito mais forte na via mTOR do que outros aminoácidos.
Em um artigo de 2014, pesquisadores do Whitehead Institute descobriram que uma família de proteínas chamada Sestrins era responsável por comunicar a presença de leucina à via mTOR, especificamente mTORC1, o complexo de detecção de nutrientes. (A proteína mTOR é um componente essencial em dois complexos proteicos diferentes, mTORC1 e mTORC2, que desempenham papéis diferentes no corpo. mTORC1, é sensível a nutrientes e controla a síntese de proteínas e o crescimento celular em resposta, enquanto o mTORC2 está envolvido na sinalização celular e regulação metabólica.) Em células cultivadas, Sestrin1 e Sestrin2 inibem a sinalização mTORC1 interagindo e suprimindo um complexo proteico chamado GATOR2. Quando GATOR2 é suprimido, a via mTOR não pode permanecer ativa.
Esta pesquisa ocorreu em cultura de células, no entanto, permaneceram dúvidas sobre como esse mecanismo estava ocorrendo em camundongos vivos. "Estudar uma população de células homogêneas em um prato é muito diferente de um animal", disse ele. "Nós realmente queríamos entender o que os resultados da cultura de células significavam para o que a leucina faz no corpo".
Cangelosi passou seus anos de pós-graduação desenvolvendo modelos de camundongos sem Sestrins para testar se as proteínas estavam desempenhando o mesmo papel em modelos animais que estavam em um prato. Ele então alimentou esses camundongos, assim como os camundongos de controle, com uma dieta completamente livre de leucina. Quando camundongos normais foram privados de leucina, eles foram capazes de compensar desligando a via mTOR e diminuindo/interrompendo o metabolismo. Mas quando os camundongos sem Sestrinas (e, portanto, a capacidade de sentir a leucina) foram alimentados com a dieta livre de leucina, eles perderam drasticamente gordura e massa muscular.
Como na cultura de células, a via de detecção de leucina dependia do complexo proteico GATOR2 e era específica para mTORC1 (não mTORC2). Um novo insight dos modelos animais foi que a detecção de leucina estava concentrada em áreas específicas do fígado. Essas zonas, chamadas lóbulos hepáticos, são arranjos hexagonais de células que direcionam o sangue rico em nutrientes do intestino através do sistema de filtragem do fígado e para a circulação do corpo.
"O fígado essencialmente vê tudo o que você come antes do resto do seu corpo", disse Cangelosi. "Ele age como uma espécie de portal de nutrientes no corpo, e diferentes células no fígado têm propriedades diferentes dependendo de seu arranjo. Definitivamente, parece que o corpo está aproveitando as sestrinas para tornar a via mTOR sensível ou não à leucina, dependendo do onde precisa estar ou não."
A percepção de que, mesmo dentro do fígado, nem todas as células respondem da mesma forma à presença ou ausência de leucina sugere uma visão mais complexa desse processo metabólico, disse Cangelosi. “Isso aponta para uma maneira muito nova pela qual todo o caminho funciona no corpo – que é conectado de maneira diferente em diferentes contextos em diferentes configurações, para que a função metabólica celular possa ser realmente ditada pelo ambiente específico da célula ou tecido”.
Embora alguns medicamentos sejam projetados para induzir a perda de gordura, Cangelosi enfatizou que a perda de gordura observada nos camundongos insensíveis à leucina não é saudável. "Eu não acho que poderia ser considerado benéfico", disse ele. "A via mTOR é um processo de preservação de nutrientes que é importante, e os camundongos também perderam muita massa muscular. Esta não é uma reprogramação metabólica saudável - foi uma resposta muito ruim para os camundongos."
A pesquisa de Cangelosi poderia informar terapias de outras maneiras, no entanto. Compreender como os processos relacionados ao mTOR funcionam de maneira diferente em vários tipos de células pode levar a terapias para alguns tipos de câncer e outras doenças que afetam o metabolismo celular. Atualmente, os medicamentos direcionados ao mTOR – especificamente aqueles baseados na droga imunossupressora rapamicina – geralmente param em ensaios clínicos devido à falta de especificidade.
“Quando [medicamentos direcionados ao mTOR] são administrados às pessoas, o problema sempre se resume a como eles simplesmente desligam tudo o que o mTOR faz”, disse Cangelosi. "Se tivermos uma melhor compreensão de como podemos direcionar especificamente complexos mTOR distintos - e isso pode ser um tiro no escuro, mas se pudermos identificar maneiras de direcionar em regiões específicas do corpo, mesmo células específicas do corpo - que são importante para a doença ou patologia que estamos tentando tratar, isso seria fundamental para se livrar dos efeitos colaterais negativos que limitam isso na clínica por tanto tempo."
A pesquisa foi publicada na
Science .
