Como o genoma é empacotado em cromossomos que podem ser movidos fielmente durante a divisão celular
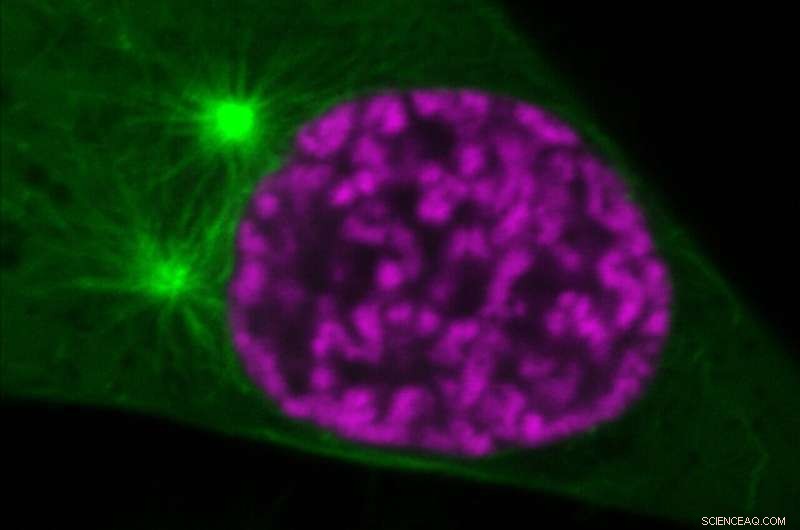
Organização dos cromossomos mitóticos (magenta) e microtúbulos do fuso (verde) em uma fase inicial da divisão celular. Logo após o que é mostrado na imagem, os microtúbulos invadirão o espaço nuclear. No entanto, a compactação da cromatina regulada pela acetilação das histonas impedirá a perfuração dos cromossomos pelos microtúbulos. Crédito:©Gerlich/IMBA
Pesquisadores do Grupo Gerlich do IMBA – Instituto de Biotecnologia Molecular da Academia Austríaca de Ciências – descobriram um mecanismo molecular que confere propriedades físicas especiais aos cromossomos na divisão de células humanas para permitir seu transporte fiel à progênie. A equipe mostrou como uma modificação química estabelece um limite de superfície nítido nos cromossomos, permitindo-lhes resistir à perfuração por microtúbulos do aparato do fuso. Os resultados são publicados na revista
Nature .
Quando as células se dividem, elas precisam transportar exatamente uma cópia do genoma para cada uma das duas células filhas. A segregação fiel do genoma requer o empacotamento de moléculas de DNA cromossômico extremamente longas em corpos discretos para que possam ser movidas eficientemente pelo fuso mitótico, um sistema de filamentos composto por milhares de microtúbulos. As novas descobertas do Gerlich Research Group do IMBA – Instituto de Biotecnologia Molecular da Academia Austríaca de Ciências – lançam luz sobre como os cromossomos mitóticos resistem às constantes forças de empurrar e puxar geradas pelos microtúbulos. "Em meio a esse sistema complexo, as propriedades físicas distintas são conferidas aos cromossomos, alterando os níveis de acetilação de histonas, uma modificação química dentro da fibra de cromatina", diz o líder do grupo IMBA, Daniel Gerlich.
Trabalhos anteriores mostraram que, em células em divisão, as fibras de cromatina são dobradas em alças por um grande complexo de proteínas chamado condensina. No entanto, o papel da condensina por si só não poderia explicar por que os cromossomos aparecem como corpos densos com uma superfície afiada em vez de uma estrutura solta semelhante a uma escova de garrafa. Alguns estudos sugeriram um papel da acetilação de histonas na regulação do nível de compactação durante a divisão celular, mas a interação da acetilação de histonas com a condensina e sua relevância funcional permaneceram obscuras. "Com nosso trabalho, agora podemos destrinchar conceitualmente os dois mecanismos", afirma Gerlich.
A equipe variou os níveis de acetilação de condensina e histona para estudar seus efeitos precisos. A remoção da condensina interrompeu a forma alongada dos cromossomos nas células em divisão e diminuiu sua resistência às forças de tração, mas não afetou seu nível de compactação. A combinação da depleção da condensação com um tratamento que aumenta os níveis de acetilação das histonas causou descompactação maciça da cromatina nas células em divisão e perfuração dos cromossomos pelos microtúbulos.
Os pesquisadores levantaram a hipótese de que a cromatina é organizada como um gel inchado durante a maior parte do ciclo celular (quando é relativamente altamente acetilado) e que esse gel se compacta em uma forma insolúvel durante a divisão celular quando os níveis de acetilação diminuem globalmente. Eles então desenvolveram um ensaio para sondar a solubilidade da cromatina fragmentando os cromossomos mitóticos em pequenos pedaços. Os fragmentos de cromossomos mitóticos formaram gotículas de cromatina líquida, mas quando o nível de acetilação foi aumentado, os fragmentos de cromatina se dissolveram no citoplasma. Essas observações suportam um modelo onde uma redução global da acetilação da cromatina durante a mitose estabelece um gel de cromatina imiscível com um limite de fase nítido, fornecendo uma base física para a resistência contra a perfuração de microtúbulos.
Com mais experimentos envolvendo cromatina pura que foi reconstituída in vitro e sondando o acesso à cromatina por várias macromoléculas solúveis, a equipe descobriu que a cromatina imiscível forma uma estrutura densa em carga negativa que exclui macromoléculas e microtúbulos carregados negativamente. "Nosso estudo mostra como o looping de DNA pelo complexo de condensação coopera com um processo de separação de fase da cromatina para construir cromossomos mitóticos que resistem às forças de puxar e empurrar exercidas pelo fuso. A desacetilação das histonas durante a divisão celular confere propriedades físicas únicas aos cromossomos que são necessários para sua segregação fiel", conclui Daniel Gerlich.
