Novo estudo sobre o parasita patogênico Leishmania lança luz sobre a evolução da maquinaria de produção de força das células
Crédito:Grupo Pekka Lappalainen
Leishmania são parasitas protozoários flagelados que dependem de hospedeiros de flebotomíneos e mamíferos. As espécies de Leishmania causam doenças graves, especialmente em países tropicais. Devido ao seu ciclo de vida peculiar e sua distância evolutiva de mais de um bilhão de anos dos humanos, a biologia celular dos parasitas de Leishmania apresenta diferenças notáveis em relação às células humanas.
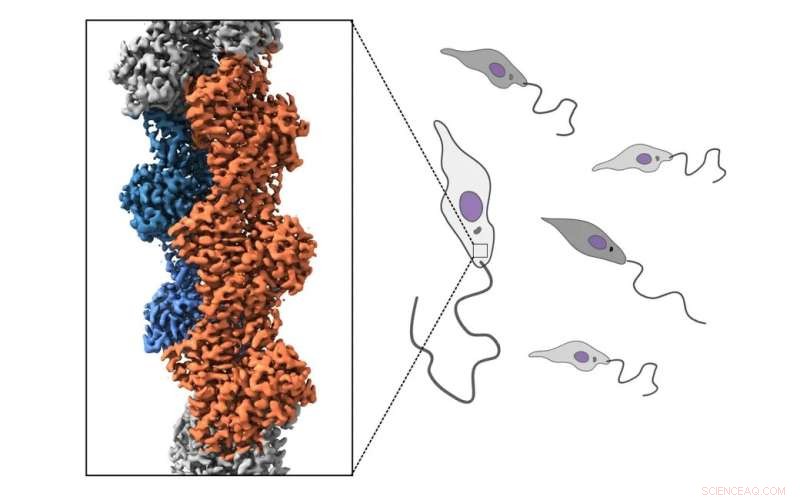
Os parasitas de Leishmania têm um citoesqueleto de actina, que é uma rede complexa e dinâmica de filamentos compostos por uma proteína chamada actina. Em humanos, o citoesqueleto de actina medeia muitos dos processos nas células, como migração, morfogênese e absorção de nutrientes. Em parasitas de Leishmania, o citoesqueleto de actina parece conduzir apenas a absorção de nutrientes. Tanto a actina de Leishmania em si quanto as proteínas que regulam o citoesqueleto de actina do parasita são muito diferentes das dos humanos.
Um novo estudo realizado na Universidade de Helsinque, Finlândia e na Université Paris Cité, CNRS, Institut Jacques Monod, França revelou como o citoesqueleto de actina é regulado no parasita Leishmania major. De acordo com o estudo, os filamentos de actina desse parasita evolutivamente distante são muito mais dinâmicos em comparação com os filamentos de actina nas células humanas. Através da determinação das estruturas atômicas dos filamentos de actina do parasita, o estudo também revela a base molecular da renovação notavelmente rápida dos filamentos de actina de Leishmania.
Ao se concentrar na actina mais divergente estudada até agora, este trabalho lança luz sobre as origens evolutivas do citoesqueleto de actina.
"Nosso estudo sugere que os filamentos de actina de eucariotos antigos eram muito dinâmicos. Com a evolução, o citoesqueleto de actina tornou-se mais complexo e mais envolvido em um número maior de funções celulares. Propomos que isso foi acompanhado pela estabilização dos filamentos de actina e a simultânea aparecimento de uma ampla gama de proteínas, que aceleram e controlam a dinâmica dos filamentos de actina", diz o principal autor do estudo, Tommi Kotila, da Universidade de Helsinque.
As diferenças estruturais entre o parasita Leishmania e as actinas humanas também podem ser exploradas para gerar inibidores específicos contra as actinas do parasita.
"Os medicamentos anti-leishmania atualmente disponíveis têm problemas de toxicidade e os parasitas desenvolveram maneiras de obter resistência aos medicamentos. Assim, precisamos de medicamentos novos e mais específicos para o tratamento da leishmaniose, e compostos contra a actina podem ser bons candidatos", diz o professor da Academia Pekka Lappalainen, da a Universidade de Helsinque.
A pesquisa é publicada em
Nature Communications .
+ Explorar mais Desvendado o mistério da motilidade celular — a proteína que recarrega a maquinaria de motilidade da célula revelada
