Uma única proteína controla os sinais de envelhecimento de forma mais eficaz do que em uma equipe
Crédito:Universidade de Colônia
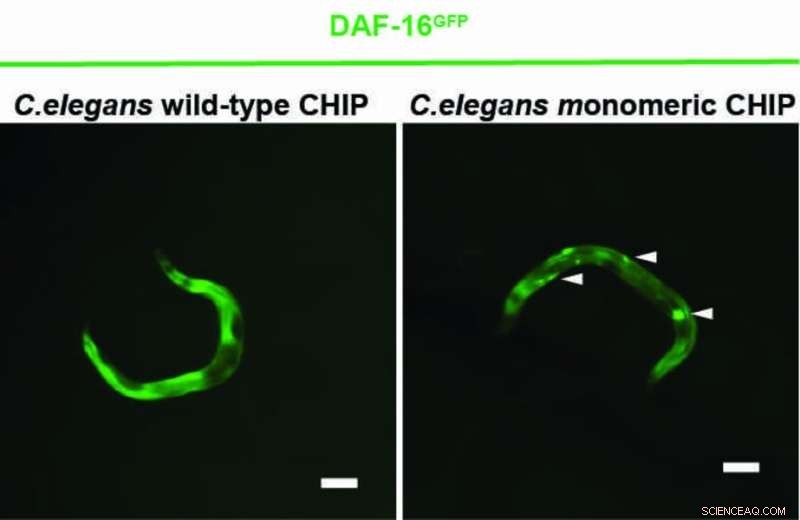
Um novo estudo mostra que a proteína CHIP pode regular o receptor de insulina de forma mais eficiente sozinha do que em um estado emparelhado. Em situações de estresse celular, o CHIP geralmente aparece como um homodímero – uma associação de duas proteínas idênticas – e serve principalmente para degradar proteínas mal dobradas e defeituosas. CHIP, assim, limpa a célula. Para este fim, o CHIP colabora com proteínas auxiliares para anexar uma cadeia da pequena proteína ubiquitina a proteínas mal dobradas. As proteínas defeituosas são assim reconhecidas e eliminadas pela célula. Além disso, o CHIP também regula a transdução de sinal do receptor de insulina. O CHIP liga a ubiquitina ao receptor para degradá-lo e interromper a ativação de produtos gênicos que prolongam a vida.
Uma equipe de pesquisa com sede em Colônia, liderada pelo Prof. Dr. Thorsten Hoppe, mostrou agora em experimentos com o nematóide Caenorhabditis elegans e células humanas que o CHIP também pode se rotular com ubiquitina, o que impede sua formação de dímeros. O monômero CHIP é mais eficiente que o dímero CHIP na regulação da sinalização de insulina. O estudo do Cluster of Excellence for Cellular Stress Responses in Aging-Associated Diseases (CECAD) da Universidade de Colônia foi publicado em
Molecular Cell sob o título "A Dimer-Monomer Switch Controls CHIP-Dependent Substrate Ubiquitylation and Processing."
"Se o CHIP funciona sozinho ou como um par depende do estado da célula. Sob estresse, há muitas proteínas mal dobradas, bem como as proteínas auxiliares que se ligam ao CHIP e impedem a auto-ubiquitilação, a auto-rotulagem com ubiquitina," disse Vishnu Balaji, primeiro autor do estudo.
"Depois que o CHIP limpa com sucesso as proteínas defeituosas, ele também pode marcar as proteínas auxiliares para degradação. Isso permite que o CHIP se ubiquite e funcione como um monômero novamente", explicou ele. Assim, para que o corpo funcione sem problemas, deve haver um equilíbrio entre os estados monoméricos e diméricos do CHIP.
"É interessante que o equilíbrio monômero-dímero do CHIP parece ser interrompido em doenças neurodegenerativas", disse Thorsten Hoppe. "Nas ataxias espinocerebelares, por exemplo, diferentes sítios de CHIP são mutados, e funciona predominantemente como um dímero. Aqui, uma mudança para mais monômeros seria uma abordagem terapêutica possível."
Na próxima etapa, os cientistas querem descobrir se existem outras proteínas ou receptores aos quais o monômero CHIP se liga e, assim, regula sua função. Os pesquisadores também estão interessados em descobrir em quais tecidos e órgãos e em quais doenças os monômeros ou dímeros CHIP ocorrem em maior número, para poder desenvolver terapias mais direcionadas no futuro.
+ Explorar mais A ligação entre agregação de proteínas e envelhecimento
