Os avanços da microscopia crioeletrônica trazem a vida em nível atômico para uma visão mais clara
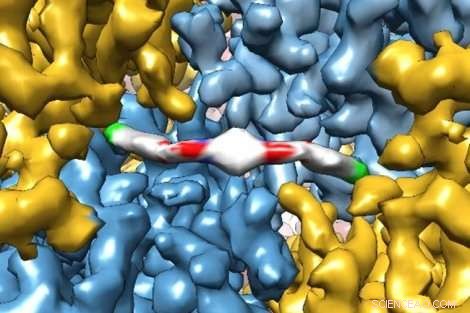 p Uma imagem inovadora de microscopia crioeletrônica mostra em detalhes extremos como uma nova molécula terapêutica interage com uma proteína, dando aos pesquisadores uma visão de como ele funciona no corpo humano. A molécula, ISRIB, foi mostrado em um estudo recente de Peter Walter da UCSF, PhD, e Susanna Rosi, PhD, para restaurar a falha de memória em pacientes com lesão cerebral traumática. Crédito:Adam Frost Lab
p Uma imagem inovadora de microscopia crioeletrônica mostra em detalhes extremos como uma nova molécula terapêutica interage com uma proteína, dando aos pesquisadores uma visão de como ele funciona no corpo humano. A molécula, ISRIB, foi mostrado em um estudo recente de Peter Walter da UCSF, PhD, e Susanna Rosi, PhD, para restaurar a falha de memória em pacientes com lesão cerebral traumática. Crédito:Adam Frost Lab
p Pesquisadores da UC San Francisco recentemente capturaram imagens requintadas de uma proteína capturada no ato de se ligar a uma nova droga terapêutica com resolução suficiente para modelar como os átomos individuais da proteína e da droga se alinhavam. p Até recentemente, tal façanha seria considerada impossível, mas nos últimos cinco anos, tais descobertas tornaram-se quase comuns aqui, parte de uma revolução de resolução liderada por pesquisadores da UCSF.
p Graças aos seus recentes avanços na microscopia crioeletrônica (crio-EM) - uma técnica cujos inventores foram homenageados com o Prêmio Nobel de Química de 2017 - esses pesquisadores permitiram um rápido progresso na busca por terapias mais precisas e poderosas para uma ampla gama de doenças humanas.
p As proteínas são minúsculas máquinas moleculares que impulsionam tudo o que nossas células fazem - e também são os alvos primários de drogas farmacêuticas. Descobrir como as novas proteínas funcionam pode levar a terapias que salvam vidas para o câncer ou a novos analgésicos com menos risco de vício.
p Mas para realmente entender como as proteínas funcionam, os pesquisadores devem ser capazes de visualizá-los em escala atômica. Anteriormente, isso exigia o crescimento meticuloso de cristais de uma proteína - um processo que poderia levar anos para ser acertado - e, em seguida, o disparo de raios-X através dos cristais para calcular a composição atômica da proteína. Infelizmente, muitas das proteínas e complexos mais interessantes não podem ser cristalizados.
O que é crio-EM? Assista a este vídeo que explica a tecnologia e o processo. Crédito:Universidade da Califórnia, São Francisco p O Cryo-EM existe desde os anos 1970, mas desde 2013 os avanços técnicos foram pioneiros em parte por David Agard da UCSF, PhD, e Yifan Cheng, PhD, melhoraram drasticamente a capacidade do crio-EM de resolver tanto a menor quanto a mais complexa das proteínas em detalhes impressionantes, transformando o microscópio eletrônico de um burro de carga antigo no fundo do laboratório para a mais nova superestrela científica quase da noite para o dia.
p Este renascimento crio-EM foi estimulado pelos esforços de Agard e Cheng para desenvolver hardware e software de câmera capaz de detectar elétrons individuais - uma meta que há muito era considerada impraticável pelo campo, mas que a dupla conquistou reunindo cientistas e engenheiros da UCSF, Laboratório Nacional Lawrence Berkeley, e Gatan, um Pleasanton, Califórnia, empresa que fabrica câmeras EM.
p "Não muito tempo atrás, todo o campo pensava que contar elétrons únicos nunca funcionaria, "Lembra Cheng." Mas na UCSF, a cultura nos estimula a fazer coisas que todo mundo pensa que é impossível. "
p Apesar do ceticismo de muitos de seus pares, Agard e Cheng - ambos professores de bioquímica e biofísica na UCSF e investigadores do Howard Hughes Medical Institute - reconheceram que a captura de elétrons únicos era crítica para a capacidade do microscópio eletrônico de resolver proteínas biológicas importantes em detalhes suficientes para permitir que os cientistas entendessem sua função.
 p Uma ilustração mostra as imagens crio-EM possíveis antes de 2013 na extrema esquerda e imagens crio-EM de resolução muito mais alta disponíveis hoje à direita. Essas imagens de alta resolução possibilitam que os pesquisadores construam modelos moleculares de proteínas de difícil estudo (extrema direita). Crédito:Martin Högbom / The Royal Swedish Academy of Science
p Uma ilustração mostra as imagens crio-EM possíveis antes de 2013 na extrema esquerda e imagens crio-EM de resolução muito mais alta disponíveis hoje à direita. Essas imagens de alta resolução possibilitam que os pesquisadores construam modelos moleculares de proteínas de difícil estudo (extrema direita). Crédito:Martin Högbom / The Royal Swedish Academy of Science
p "Não é apenas uma questão de ver as proteínas com um pouco mais de clareza, "Agard explicou." Há um ponto preciso onde você vai de ver bolhas um tanto inúteis para ser capaz de interpretar diretamente a estrutura de uma molécula. As câmeras de contagem de elétrons realmente forneceram um salto quântico em nossa capacidade de entender a química subjacente de uma proteína - tanto como ela funciona quanto como você poderia desenvolver drogas que se ligam a ela. "
p Desde seu primeiro artigo de grande sucesso em 2013, demonstrando que as novas câmeras e software podem resolver proteínas em resolução quase atômica, a tecnologia tem sido amplamente adotada pelo campo. Também possibilitou grandes avanços nas pesquisas do próprio Cheng e Agard, desde a compreensão das proteínas essenciais à sensação de dor, que poderia ser direcionado por uma nova geração de produtos farmacêuticos, a descobertas sobre como as proteínas mantêm sua forma adequada, que tem implicações importantes para o câncer e doenças como a doença de Alzheimer, que são caracterizadas por proteínas deformadas.
p Outro importante pesquisador crio-EM da UCSF, Adam Frost, MD, PhD, que ingressou na universidade como professor assistente em 2014 para aproveitar o poder desta nova tecnologia, tem liderado esforços para usar crio-EM para determinar como novas classes de drogas se ligam a suas proteínas-alvo em nível atômico.
p "Cryo-EM is now allowing us to study proteins at a level of detail that would never have been possible just a few years ago, " Frost said.
This video shows a three-dimensional model of the TRPV1 protein at 3.4 Angstroms, bound by both spider toxin (pink) and resiniferatoxin (red spheres). Resiniferatoxin occupies the same binding sites as capsaicin, the compound that gives chilies their “heat.” The protein’s four subunits are colored light yellow, azul, green and red. As the model rotates to show top and bottom views, the central channel through which ions pass into the cell is visible. Credit:Cheng lab p Frost and Cheng have also been using cryo-EM to understand how signaling proteins on the surfaces of cells – key targets for pharmaceuticals from pain killers to cancer therapies – are influenced by the cell membranes in which they float and how proteins can bend and shape the membranes. Notavelmente, the ability to examine the structure of proteins in their native membranes – which had also been considered impossible by the field – was achieved for the first time in 2016 by Cheng.
p The recent work with cryo-EM has been so successful that many researchers at UCSF have begun clamoring for a share of the limited microscopy time available on shared scopes. Felizmente, with the acquisition earlier this year of new fully automated cryo-electron microscopes, including a $5 million state-of-the-art Titan Krios system funded by the Howard Hughes Medical Institute, a $6 million Titan Krios funded by an anonymous donor for the UCSF Institute of Neurodegenerative Disease – part of the UCSF Weill Institute for Neurosciences – and a $3 million Arctica system funded by the National Institutes of Health and UCSF, more and more researchers across the University and the Bay Area will be able to take their research to the next level.
p Agard sees the cryo-EM revolution as closely synergistic to other burgeoning efforts on campus to completely map out the biology of disease, such as the work of Nevan Krogan, PhD, the director of UCSF's Quantitative Biosciences Institute, who is mapping the common networks of genes and proteins that drive diseases ranging from cancer to HIV to schizophrenia; and the work of Brian Shoichet, PhD, whose lab in UCSF's School of Pharmacy uses protein structures to computationally design custom drugs that fit like lock and key into target proteins.
p "There is a remarkably integrated pipeline being developed at UCSF, with new technologies and approaches feeding off one another to advance our knowledge of the biology of disease at every level, " Agard said. "This is beginning to have a huge impact all around campus, but now we need to scale it up to lower barriers and speed the transition from images to therapies."

