A matéria existe em muitos tamanhos, formas e cores diferentes. Considere o cloro, um gás amarelado ou chumbo, um sólido cinza-preto ou mercúrio, um líquido prateado. Três elementos muito diferentes, cada material feito de apenas um tipo de átomo. As diferenças na matéria se resumem às menores diferenças na estrutura atômica.
TL; DR (muito longo; não leu)
Entenda que os isótopos de um elemento têm números de massa diferentes, mas o mesmo número de prótons. Usando a Tabela Periódica, encontre o número atômico do elemento. O número atômico é igual ao número de prótons. Em um átomo equilibrado, o número de elétrons é igual ao número de prótons. Em um átomo desequilibrado, o número de elétrons é igual ao número de prótons mais o oposto da carga de íons. Calcule o número de nêutrons subtraindo o número atômico do número de massa. Se o número de massa de um isótopo específico não for conhecido, use a massa atômica da Tabela Periódica, arredondada para o número inteiro mais próximo, menos o número atômico para encontrar o número médio de nêutrons para o elemento.
Estrutura dos átomos
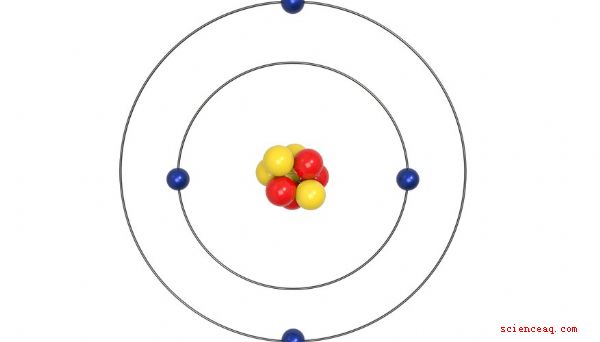
Três partículas principais formam cada átomo. Prótons e nêutrons aglomeram-se no núcleo no centro do átomo. Os elétrons formam uma nuvem girando em torno do núcleo. Prótons e nêutrons compõem a massa de átomos. Os elétrons, minúsculos em comparação com os prótons e nêutrons, contribuem muito pouco para a massa geral de átomos.
Átomos e isótopos
Os átomos do mesmo elemento têm o mesmo número de prótons. Todos os átomos de cobre têm 29 prótons. Todos os átomos de hélio têm 2 prótons. Isótopos ocorrem quando átomos do mesmo elemento têm massas diferentes. Como o número de prótons de um elemento não muda, a diferença de massa ocorre devido a diferentes números de nêutrons. O cobre, por exemplo, possui dois isótopos, cobre-63 e cobre-65. O cobre-63 possui 29 prótons e um número de massa de 63. O cobre-65 possui 29 prótons e o número de massa 65. O hélio possui 2 prótons e quase sempre possui um número de massa 4. Muito raramente, o hélio forma o isótopo hélio-3, que ainda possui 2 prótons, mas possui um número de massa igual a 3.
Um método para escrever a fórmula de um isótopo mostra o nome ou símbolo do elemento seguido pelo número de massa, como hélio-4 ou He-4. Outra identificação abreviada de isótopos mostra o número de massa como um sobrescrito e o número atômico como um subscrito, ambos mostrados precedendo o símbolo atômico. Por exemplo, 4 2He indica o isótopo de hélio com número de massa 4. O arranjo da Tabela Periódica de Elementos fornece informações essenciais para encontrar o número de prótons , nêutrons e elétrons nos átomos. A moderna Tabela Periódica coloca os elementos em ordem de seus prótons. O primeiro elemento da mesa, hidrogênio, tem um próton. O último elemento (pelo menos por enquanto) da tabela, Oganesson ou Ununoctium, possui 118 prótons. O número atômico na Tabela Periódica identifica o número de prótons em qualquer átomo de esse elemento. O cobre, número atômico 29, possui 29 prótons. Encontrar o número atômico de um elemento revela o número de prótons. A diferença entre isótopos de um elemento depende do número de nêutrons. Para encontrar o número de nêutrons em um isótopo, encontre o número de massa do isótopo e o número atômico. O número atômico, ou número de prótons, é encontrado na Tabela Periódica. A massa atômica, também encontrada na Tabela Periódica, é a média ponderada de todos os isótopos do elemento. Se nenhum isótopo for identificado, a massa atômica pode ser arredondada para o número inteiro mais próximo e usada para encontrar o número médio de nêutrons. Por exemplo, a massa atômica de mercúrio é 200,592. Mercúrio possui vários isótopos com números de massa variando de 196 a 204. Usando a massa atômica média, calcule o número médio de nêutrons arredondando primeiro a massa atômica de 200,592 a 201. Agora, subtraia o número de prótons 80 da massa atômica , 201-80, para encontrar o número médio de nêutrons, 121. Se o número de massa de um isótopo é conhecido, o número real de nêutrons pode ser calculado. Use a mesma fórmula, número de massa menos número atômico, para calcular o número de nêutrons. No caso do mercúrio, o isótopo mais comum é o mercúrio-202. Use a equação 202-80 \u003d 122 para descobrir que o mercúrio-202 possui 122 nêutrons. Um isótopo neutro não tem carga, o que significa que as cargas positivas e negativas se equilibram em um isótopo neutro. Em um isótopo neutro, o número de elétrons é igual ao número de prótons. Como encontrar o número de prótons, encontrar o número de elétrons em um isótopo neutro exige encontrar o número atômico do elemento. Em um íon, um isótopo com carga positiva ou negativa, o número de prótons não '. t igual ao número de elétrons. Se os prótons superam os elétrons, o isótopo tem mais cargas positivas do que cargas negativas. Em outras palavras, o número de prótons excede o número de elétrons pelo mesmo número da carga positiva. Se o número de elétrons exceder o número de prótons, a carga do íon será negativa. Para encontrar o número de elétrons, adicione o oposto do desequilíbrio de carga ao número de prótons. Por exemplo, se um isótopo tem uma carga -3, como no fósforo (número atômico 15), então o número de elétrons é três maior que o número de prótons. O cálculo do número de elétrons passa a ser 15 + (- 1) (- 3) ou 15 + 3 \u003d 18 ou 18 elétrons. Se um isótopo tem uma carga de +2, como no estrôncio (número atômico 38), o número de elétrons é dois a menos que o número de prótons. Nesse caso, o cálculo se torna 38 + (- 1) (+ 2) \u003d 38-2 \u003d 36, então o íon tem 36 elétrons. A abreviação usual para íons mostra o desequilíbrio de carga como um sobrescrito após o símbolo atômico. No exemplo do fósforo, o íon seria escrito como P -3.
Tabela Periódica de Elementos
Quantos prótons?
Quantos nêutrons?
Quantos elétrons?