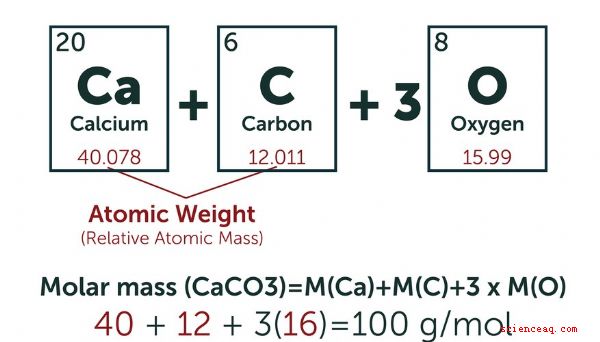
Para simplificar seus cálculos, os químicos criaram uma unidade padrão para o número de átomos de um composto específico envolvido em uma reação ou em algum outro processo químico. Eles definem uma mole (mol) como a quantidade de qualquer substância que tenha o mesmo número de unidades fundamentais de 12 gramas de carbono-12, que é o número de Avogadro (6,022 × 10 23). O sistema de medição SI (métrico) define um milimole (Mmol) como um milésimo de mole. Você geralmente calcula o número de moles de uma substância pesando a quantidade que você tem em mãos. Se você quiser converter para Mmol, multiplique por 10 3 (1,000). TL; DR (Demasiado longo; não leu) Uma mole é igual ao número de Avogadro de partículas de um composto particular. Um milimole (Mmol) é um milésimo de um mole. Como calcular Moles As massas atômicas são medidas em unidades de massa atômica (AMU). Uma AMU é exatamente 1/12 da massa do núcleo de um átomo de carbono-12 em seu estado fundamental. Uma mole de uma substância é definida para ser igual ao número de partículas de Avogadro dessa substância. De acordo com esta definição, o peso de uma mole de uma substância em gramas é o mesmo número que o peso de uma partícula individual dessa substância na AMU. Por exemplo, o peso atômico do carbono-12 é 12 AMU, então uma mole de carbono-12 pesa 12 gramas. Considere um recipiente cheio de gás hidrogênio (H <2>). Cada partícula no recipiente é uma molécula que consiste em dois átomos de hidrogênio, então você só precisa conhecer a massa atômica de hidrogênio para calcular o peso molecular. A maioria das versões da tabela periódica lista a massa atômica de cada elemento sob seu símbolo. Para o hidrogênio, que tem um único próton em seu núcleo, é 1.008 AMU, que é uma média de todos os isótopos naturais do hidrogênio. Consequentemente, a massa atômica do gás hidrogênio é de 2,016 AMU, e uma mole de gás hidrogênio pesa 2,016 gramas. Para encontrar o número de moles em sua amostra, você pesaria a amostra em gramas e dividiria esse peso pelo peso molecular do gás hidrogênio em gramas. Por exemplo, uma amostra pesando 15 gramas de gás hidrogênio puro contém 7,44 moles. Convertendo para Mmol Às vezes, as quantidades sob investigação são tão pequenas que expressá-las em moles é incômodo. Digite o milimole. Multiplicando o número de moles por mil, você pode converter um número muito pequeno em um mais gerenciável. Isso é especialmente conveniente quando se lida com unidades de volume na ordem de mililitros. 1 mol = 1.000 Mmol Concentração de solução Químicos usam molaridade como uma medida de concentração de um composto particular em solução. Eles definem a molaridade como o número de moles por litro. Você converte a molaridade em milimolaridade multiplicando por 1.000. Por exemplo, uma solução de 1 mol (molar, também escrita como M) tem uma concentração de 1 mole por litro. Isso equivale a uma solução de 1.000 Mmol (milimolar, também às vezes escrita como mM), que contém 1.000 Mmol por litro. Exemplo Uma solução contém 0,15 grama de carbonato de cálcio. Quantos milimoles é isso? A fórmula química do carbonato de cálcio é CaCO 3. O peso atômico do carbono (C) é de aproximadamente 12 AMU, o oxigênio (O) de aproximadamente 16 AMU e o de cálcio (Ca) de aproximadamente 40 AMU. Cada molécula de carbonato de cálcio, portanto, pesa 100 AMU, o que significa que uma toupeira pesa aproximadamente 100 gramas. Um peso de 0,15 gramas representa 0,15 g ~ 100 g /mol = 0,0015 moles. Isso é equivalente a 1,5 Mmol. Qual é a molaridade e a milimolaridade desse carbonato de cálcio em 2,5 litros de solução? A molaridade é definida como o número de moles por litro, então divida o número de moles por 2,5 para obter a molaridade: 0,0015 ÷ 2,5 = 0,0006 M Multiplique por 1.000 para obter a milimolaridade = 0,6 mM Observe que você chega ao mesmo resultado por milimolaridade se dividir o número de milimoles pelo volume de solução.