Crédito: Ciência Química (2020). DOI:10.1039 / D0SC04993J
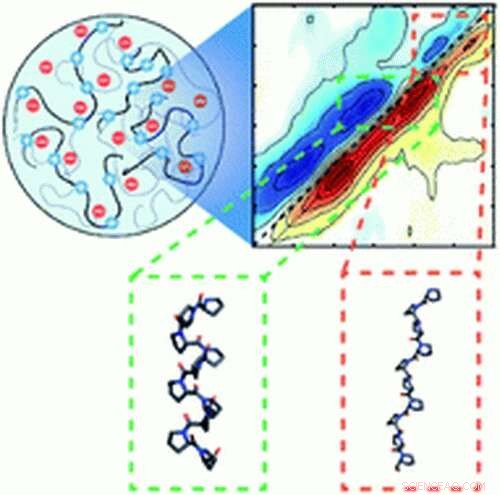
Os cientistas descobriram a primeira evidência de dobramento de proteínas impulsionado pela separação de fase líquido-líquido, um fenômeno no qual os fluidos se formam em gotículas microscópicas e se separam dentro das células - como gotas de óleo na água.
Em um estudo publicado na revista Ciência Química , pesquisadores da Universidade de Notre Dame descobriram que concentrações elevadas de proteínas nas gotículas desencadearam um evento de dobramento, aumentando o potencial de agregação de proteínas - ou dobramento incorreto - que tem sido associada a doenças neurológicas, incluindo doença de Alzheimer e esclerose lateral amiotrófica (ELA).
"Essas proteínas específicas são intrinsecamente desordenadas - elas não têm uma estrutura bem definida - mas quando forçadas por essas gotículas, vemos evidências de dobramento, "disse Arnaldo Serrano, professor assistente do Departamento de Química e Bioquímica da Notre Dame e investigador principal do estudo. As proteínas são naturalmente disformes, como pedaços de espaguete cozido - e só funcionam quando dobrados em estruturas tridimensionais. "Imagine que você está em uma multidão, e todos na multidão têm os braços estendidos. Vocês não vão se encaixar muito bem. Você puxa seus braços, e talvez junte as mãos. Quando fica lotado, essas proteínas se condensam em uma estrutura dobrada. "
Ao longo dos anos, pesquisadores estudaram como as gotículas microscópicas, formando-se naturalmente e espontaneamente dentro das estruturas celulares, têm várias funções. As células podem direcionar e conter biomateriais perigosos dentro dos compartimentos de fluido para proteger a célula de danos. Também há evidências de que eles podem conduzir a várias reações químicas, como a agregação de proteínas.
Em seu estudo, Serrano e sua equipe usaram espectroscopia de infravermelho para medir o dobramento de uma proteína específica associada com ALS. Os lasers infravermelhos criam pulsos de luz, geração de frequências vibracionais que atuam como um identificador semelhante a uma impressão digital. A frequência identifica de forma única e precisa a estrutura de uma proteína dobrada ou desdobrada.
Embora a pesquisa não tenha testado evidências de agregação das proteínas, Serrano explicou que o dobramento e a agregação de proteínas estão intimamente ligados.
"Você pode pensar na agregação como um evento de dobramento de segunda ordem, ", disse ele." As proteínas muitas vezes se dobram em estruturas intermediárias ao longo do caminho para a agregação. Validamos essa ideia de que as proteínas na gotícula não têm muito espaço e são forçadas a se dobrar - o próximo passo lógico é que elas são forçadas a se agregar. "
Serrano disse que ele e sua equipe estão atualmente conduzindo um estudo de acompanhamento para determinar se tal evento de dobramento poderia de fato servir como um primeiro passo para o dobramento incorreto em outras proteínas.