Proteínas antigas podem oferecer pistas sobre proteínas de engenharia para suportar altas temperaturas exigidas em aplicações industriais. Crédito:Rensselaer Polytechnic Institute
Proteínas antigas podem oferecer pistas sobre como criar proteínas que podem suportar as altas temperaturas exigidas em aplicações industriais, de acordo com uma nova pesquisa publicada no Proceedings of the National Academy of Sciences . Os pesquisadores usaram experimentos para examinar as diferenças críticas entre 15 proteínas da família da tiorredoxina, incluindo sete sequências de proteínas extintas que datam de mais de 4 bilhões de anos e foram ressuscitadas usando reconstruções de sequências ancestrais.
"Em aplicações industriais, proteínas podem fazer parte do trabalho de produtos químicos com menos energia e menos toxicidade, mas eles têm que ser capazes de suportar as altas temperaturas dos processos industriais, "disse George Makhatadze, um Professor Constellation de Biocomputação e Bioinformática e membro do Centro de Biotecnologia e Estudos Interdisciplinares do Rensselaer Polytechnic Institute. "Esta pesquisa sugere que métodos de reconstrução ancestral podem ser usados para projetar proteínas que se desdobram mais lentamente, oferecendo maior utilidade, em temperaturas mais altas. "
Os experimentos mostraram que a diferença na estabilidade entre proteínas da mesma família é causada principalmente por diferenças na energia necessária para desdobrar as proteínas, uma descoberta que sustenta uma teoria de longa data conhecida como o "princípio da frustração mínima, "proposto por físicos há cerca de 30 anos.
As proteínas são cadeias moleculares em que cada link é um de 20 aminoácidos. Uma vez que a corrente é montada, várias forças ao longo de seu comprimento interagem, fazendo com que a corda torça e gire, e, finalmente, dobre em uma forma tridimensional. A proteína só pode desempenhar sua função quando devidamente dobrada. A maioria das proteínas permanece dobrada dentro de uma determinada faixa de temperatura, pH, ou condições de pressão, quebrar quando sujeito a condições fora dessas tolerâncias.
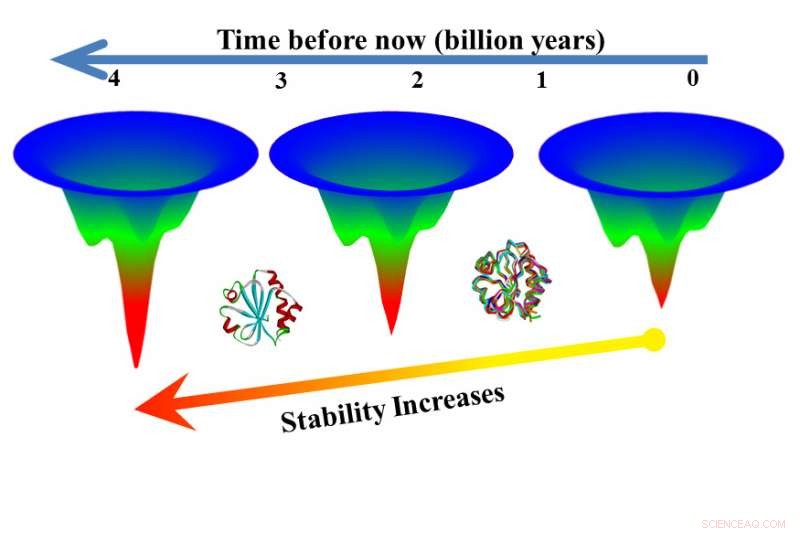
Nem todas as regras que governam o dobramento de proteínas são conhecidas, e Makhatadze queria entender como as proteínas dentro da mesma família, com estrutura semelhante, são capazes de desempenhar a mesma função de sustentação da vida em ambientes térmicos muito diferentes. Tioredoxinas, por exemplo, estão presentes em todos os organismos, desde aqueles que vivem perto de fontes hidrotermais ferventes às águas geladas do Ártico.
Uma regra conhecida ajuda a explicar por que existe um número astronômico de sequências possíveis para proteínas com centenas e até milhares de links, mas apenas um pequeno subconjunto dessas possíveis sequências é encontrado na natureza. Esta regra, o princípio da frustração mínima, postula que a natureza escolhe apenas as sequências que se dobram de forma mais eficiente, reduzindo interações indesejadas entre aminoácidos e produzindo mais rápido, menos frustrado, padrões de dobragem.
Para ser consistente com o princípio da frustração mínima, Makhatadze disse, proteínas com estrutura semelhante, mas com estabilidade termodinâmica diferente, devem se dobrar ao longo do mesmo padrão eficiente, mas aqueles com maior capacidade de tolerar o calor devem levar mais tempo para se desdobrar. Experimentos, realizado primeiro com oito tioredoxinas modernas, provou a hipótese correta.
"Testamos as taxas de dobramento entre as tioredoxinas, uma família de proteínas que desempenham a mesma função, mas - porque funcionam em diferentes condições térmicas - devem ser diferentes em termos de termodinâmica, "disse Makhatadze." E o que observamos é que, para essas proteínas, eles realmente dobram com a mesma taxa, mas eles se desdobram em uma taxa diferente - que é o que previmos. "
Na próxima etapa, pesquisadores testaram versões extintas de tioredoxinas que foram obtidas usando uma técnica chamada reconstrução de sequência ancestral. As versões extintas se desenvolveram mais lentamente do que as versões modernas, em alguns casos, dobrar 3, 000 vezes mais devagar do que uma contraparte moderna.
“Aqui temos duas versões de uma proteína da mesma família e uma desdobrada em sete segundos, o outro em seis horas, "Disse Makhatadze." Isso significa que você pode obter funções úteis da proteína por seis horas em vez de sete segundos. Isso mostra que a reconstrução da sequência ancestral pode ser uma rota para proteínas que são mais estáveis em altas temperaturas. "
A descoberta é apoiada por pesquisas publicadas anteriormente e dados geoquímicos que indicam que a Terra e seus oceanos eram mais quentes no passado.
"Pesquisas anteriores corroboram a descoberta de que proteínas mais antigas são mais estáveis, mas esta nova pesquisa mostra que essas proteínas antigas são mais estáveis porque se desenvolvem mais lentamente, "Makhatadze disse.
"Evidências para o princípio da frustração mínima na evolução das paisagens de dobramento de proteínas" podem ser encontradas usando o identificador de objeto digital DOI:10.1073 / pnas.1613892114. A pesquisa foi apoiada pela National Science Foundation. Makhatadze juntou-se à pesquisa de Fanco Tzul, um associado de pesquisa de pós-doutorado, e o estudante de graduação Daniel Vasilchuk.
A pesquisa de Makhatadze é possibilitada pela visão do The New Polytechnic, um paradigma emergente para o ensino superior que reconhece que os desafios e oportunidades globais são tão grandes que não podem ser enfrentados de forma adequada mesmo pela pessoa mais talentosa que trabalha sozinha. Rensselaer serve como uma encruzilhada para a colaboração, trabalhando com parceiros em todas as disciplinas, setores, e regiões geográficas - para enfrentar desafios globais complexos, usando as ferramentas e tecnologias mais avançadas, muitos dos quais são desenvolvidos em Rensselaer. A pesquisa em Rensselaer aborda alguns dos desafios tecnológicos mais urgentes do mundo - desde a segurança energética e o desenvolvimento sustentável até a biotecnologia e a saúde humana. O Novo Politécnico é transformador no impacto global da pesquisa, em sua pedagogia inovadora, e na vida dos alunos da Rensselaer.