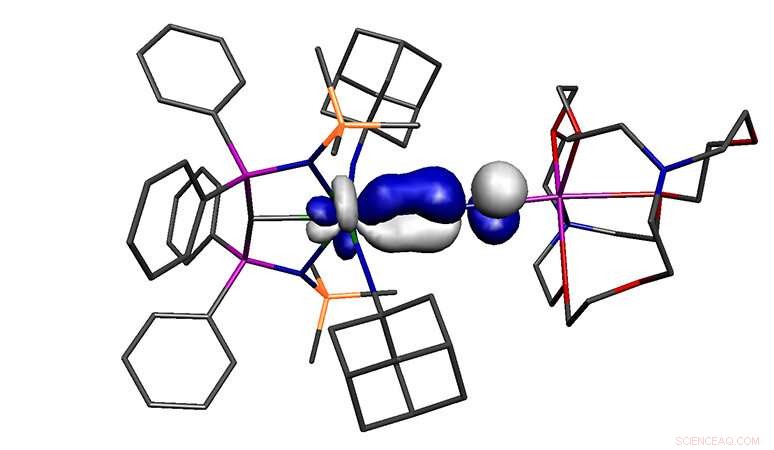
Crédito:Universidade de Manchester
Trabalho liderado pelo grupo de pesquisa do Professor Steve Liddle e publicado na prestigiosa revista Química da Natureza relatou uma molécula de dinitrogênio de urânio que, de acordo com a teoria química básica, não deveria existir. A molécula de quebra de regras pode ter implicações para a ativação do dinitrogênio, que é uma molécula essencial para a produção de fertilizantes.
Aproximadamente 450 milhões de toneladas de fertilizantes são produzidos a cada ano usando amônia feita a partir do processo Haber Bosch, e este é o fertilizante que sustenta a vida na Terra. Em Haber Bosch, o dinitrogênio se liga aos metais na superfície do catalisador e é dividido. Em seguida, ele reage com o di-hidrogênio para formar a amônia.
Dada a vasta escala em que Haber Bosh opera, por muitos anos, tem havido interesse em como o dinitrogênio se liga aos metais da Tabela Periódica em complexos moleculares - uma vez que essas espécies podem ser estudadas em detalhes atômicos - porque isso nos informa sobre as principais etapas de ligação e divisão em Haber Bosch. Isso é responsável pela maior parte das demandas de energia desse processo.
Um dos segredos mais bem guardados de Haber Bosch é que embora o ferro seja o catalisador de escolha, o urânio é, de fato, um catalisador superior - portanto, há interesse em como o urânio se liga ao dinitrogênio.
O dinitrogênio é aparentemente uma das piores moléculas para se ligar aos metais. De fato, é tão inerte que geralmente é usado como uma atmosfera protetora para sínteses químicas, e em embalagens de alimentos para evitar que os alimentos estraguem. Contudo, sob certas circunstâncias, a ligação do dinitrogênio aos metais pode ser incentivada, e, neste modelo, o metal precisa estar em um estado de baixa oxidação e ser rico em elétrons o suficiente para participar da ligação, em que o dinitrogênio doa densidade de elétrons ao metal e o metal retribui.
Segue-se que um estado de alta oxidação e metal pobre em elétrons não deve ser capaz de se envolver neste modelo de ligação porque não deve ser capaz de se envolver na parte recíproca da ligação.
A molécula relatada no estudo está em alto estado de oxidação, metal pobre em elétrons, ainda se liga ao dinitrogênio, um dos piores ligantes possíveis. Portanto, a molécula não deveria existir, ainda assim. A hipótese de trabalho de por que a molécula pode se formar é que o urânio está ligado a três ligantes doadores extremamente fortes, e apesar de seu alto estado de oxidação, esses três ligantes tornam o urânio excepcionalmente rico em elétrons, e isso substitui as restrições usuais no modelo de ligação.
Este trabalho reescreve uma regra fundamental da química, e pode ter implicações mais amplas, porque muito da química de ativação do dinitrogênio é baseada na suposição de que metais em estado de baixa oxidação são necessários. Contudo, este estudo agora mostra que os metais em estado de alta oxidação, sob as circunstâncias certas, também pode apoiar uma nova química de ativação de dinitrogênio.
Esse conhecimento permitirá que os cientistas pensem de forma diferente sobre como enfrentar os desafios da ativação do dinitrogênio, e pode até influenciar os estudos do processo Haber Bosch.