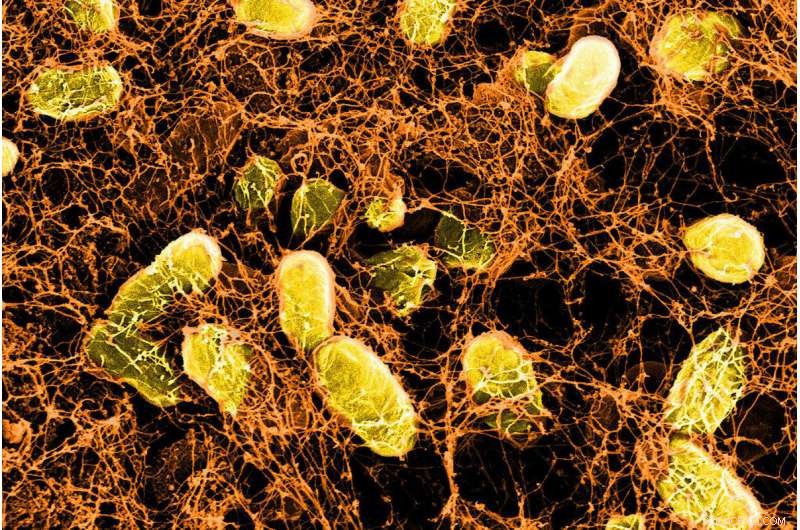
Imagem microscópica de um hidrogel bacteriano ligando-se às proteínas do muco na superfície da parede intestinal. Crédito:Wyss Institute da Harvard University
Feridas externas, como cortes na pele ou escoriações, podem ser facilmente cobertas com um simples curativo ou um remendo maior para protegê-las e facilitar sua cicatrização. Quando se trata de algumas superfícies internas, como as do intestino, que são revestidas com uma camada de muco, Contudo, tais materiais convencionais de cicatrização de feridas são ineficazes porque o muco impede a sua fixação firme e rapidamente os afasta do local da ferida.
Agora, pesquisadores do Instituto Wyss de Engenharia Inspirada na Biologia de Harvard e da Escola de Engenharia e Ciências Aplicadas John A. Paulson (SEAS) desenvolveram uma solução para esse problema na forma de hidrogéis probióticos feitos de nanofibras mucoadesivas e produzidos por uma bactéria intestinal natural projetada. Os hidrogéis podem ser facilmente produzidos a partir de culturas bacterianas e aplicados como "géis vivos" autorregeneráveis de vida mais longa ou "géis livres de células" de vida mais curta às superfícies intestinais por meio de seringas, spray, e técnicas endoscópicas para fornecer um selo. O estudo é publicado em Materiais avançados .
"Este novo tipo de material vivo projetado com sua facilidade de produção e armazenamento, biocompatibilidade, e propriedades mucoadesivas podem ser um abridor de portas para estratégias de cicatrização de feridas bioativas para uso dentro do lúmen intestinal humano, "disse Neel Joshi, que é membro do corpo docente do Wyss Institute e professor associado do SEAS. "Podemos essencialmente programar o maquinário molecular normal de produção de nanofibras de organismos não patogênicos E. coli para produzir hidrogéis que têm uma viscosidade fortemente semelhante à do muco, e com recursos mucoadesivos incorporados; e sua modularidade poderia nos permitir ajustá-los para combinar seções específicas do trato gastrointestinal com suas composições e estruturas de muco individuais. "
Joshi's e outros laboratórios já usaram cepas comensais de E. coli para secretar nanofibras formadoras de biofilme, e como fundições vivas para a fabricação de produtos farmacêuticos, produtos químicos finos, ou substâncias que podem ajudar na remediação ambiental por meio da engenharia da proteína CsgA que as bactérias secretam, que se automontam em nanofibras curli no ambiente extracelular. Nessas aplicações anteriores, CsgA foi modificado para permitir funções enzimáticas ou estruturais adicionais, como o desempenho de uma reação química necessária para a síntese de um fármaco ou produto químico. Contudo, os materiais curli à base de nanofibras até agora não foram desenvolvidos para uso direto como terapêutica.
"Biofilmes produzidos naturalmente são conhecidos por atrapalhar os processos de cicatrização de feridas até o ponto em que precisam ser ativamente gerenciados por profissionais de saúde. Essencialmente, hackeamos uma das principais máquinas que os produzem com o objetivo de longo prazo de fazer exatamente o oposto , para produzir materiais que possam apoiar a cicatrização de feridas em um ambiente que é inacessível por outros materiais, "disse a primeira autora Anna Duraj-Thatte, que é bolsista de pós-doutorado da Escola de Graduação em Artes e Ciências na equipe de Joshi.
Para permitir a formação de hidrogéis extracelulares, os pesquisadores programaram uma cepa não patogênica da bactéria intestinal E. coli para sintetizar uma variante da proteína CsgA curli que é fundida ao domínio de ligação ao muco dos fatores trevo humanos (TFFs). Os TFFs são co-secretados por células produtoras de muco para proteger os epitélios da mucosa de uma série de insultos, e ajudá-los a reparar ferimentos. Uma simples etapa de filtração permite a separação limpa do hidrogel contendo bactérias vivas do resto da cultura, enquanto os géis livres de células requerem uma etapa adicional na qual as bactérias são mortas com um simples tratamento químico. "Acreditamos que a presença dos domínios TFF permite que diferentes fibras curli se reticulem e formem uma malha de armazenamento de água, e demonstrou que as propriedades exatas do hidrogel dependem do tipo de TFF usado, "disse Duraj-Thatte.
Colaborando com Jeffrey Karp e instrutor de medicina Yuhan Lee no Hospital Brigham and Women's, a equipe testou a especificidade da adesão do tecido com base no tipo de domínios anexados no hidrogel. Quando TFFs foram apresentados nos hidrogéis, they enhanced adhesion only to the lumen-exposed mucosal surface of a goat colon tissue sample. Alternativamente, when a domain binding to fibronectin protein—which is not found on the mucosa, but on the outward-facing serosal surface of the colon—the hydrogels instead preferentially stuck to the serosal side of the colon tissue sample.
"Since hydrogels with different TFF domains can be easily sprayed onto tissue surfaces with controllable adhesion and functional activity, we envision their potential use in endoscopic procedures to treat intestinal disorders, like a spray-on bandage, " said Karp, who is a professor of medicine at Brigham and Women's Hospital and Harvard Medical School.
When given orally to mice, the cell-containing live gels could withstand the harsh pH and digestive conditions of the stomach and small intestine to reach the cecum with the bacteria intact. The team also found that hydrogels bearing one particular TFF domain (TFF2) enhanced retention of the material in the colon. "The presence of bacteria in live gels prolonged their residency times in the gut from one day to at least five days due to the bacteria's ability to continuously regenerate the curli fiber networks that are decorated with TFFs, without affecting the health of mice in any obvious way, " said Joshi.
"This is a great example of synthetic biology-based jujutsu in which Joshi's team took a major problem created by bacteria—the biofilms they create that are so difficult to access and remove—and then flipped the problem on its head through genetic engineering so that the biofilm now essentially becomes a healing Band-aid for our gut. It's an amazing example of biologically inspired engineering at its best, " said Wyss Director Donald Ingber, the Judah Folkman Professor of Vascular Biology at HMS and the Vascular Biology Program at Boston Children's Hospital, as well as professor of bioengineering at SEAS.
Esta história foi publicada como cortesia da Harvard Gazette, Jornal oficial da Universidade de Harvard. Para notícias adicionais da universidade, visite Harvard.edu.