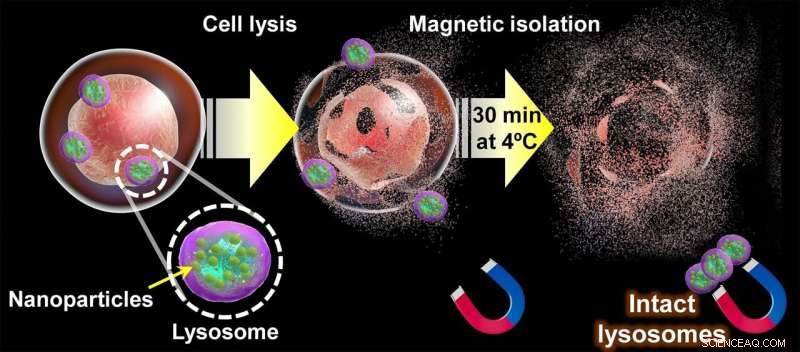
Diagrama da abordagem proposta para extrair lisossomos intactos. Uma vez que as nanopartículas magnéticas se acumulam naturalmente nos lisossomos de uma célula através da via endocítica, a membrana celular é rompida. e seu conteúdo “peneirado” por 30 minutos usando ímãs. No final desse processo, lisossomos intactos podem ser recuperados dos ímãs e usados para estudar sua estrutura, metabólitos e composição de proteínas. Crédito:Shinya Maenosono
O funcionamento correto das células depende da orquestração precisa de muitos processos e organelas complexos. Os lisossomos – organelas de células vitais – são subunidades cheias de enzimas encontradas em muitas células animais que ajudam a quebrar e reutilizar macromoléculas, como proteínas, lipídios e nucleotídeos. Além de sua função na digestão celular e no gerenciamento de resíduos, os lisossomos também participam da sinalização de aminoácidos, o que estimula a síntese de proteínas juntamente com outros efeitos.
Dado que muitas doenças são causadas por defeitos na função dos lisossomos, não é surpresa que os pesquisadores tenham tentado ativamente entender essas organelas por décadas. Mas existem apenas algumas técnicas que permitem a extração de lisossomos de dentro de uma célula. O método mais comum é chamado de "ultracentrifugação com gradiente de densidade". Envolve quebrar suavemente a membrana celular e aplicar uma força centrífuga ao conteúdo da célula. Isso separa os componentes da célula por densidade. Infelizmente, algumas outras organelas têm a mesma densidade dos lisossomos, resultando em amostras com impurezas. Além disso, o processo demora tanto que, quando termina, muitas proteínas lisossômicas já foram perdidas e/ou degradadas.
Uma técnica mais avançada, chamada "imunoprecipitação", baseia-se na modificação das proteínas de superfície dos lisossomos para que possam ser capturadas por esferas magnéticas cobertas por anticorpos especialmente adaptados. Embora essa abordagem produza resultados mais puros, a composição proteica dos lisossomos extraídos é modificada pelo procedimento e, assim, análises proteicas subsequentes podem ser comprometidas. Fica claro, então, que precisamos encontrar uma maneira melhor de extrair lisossomos das células.
Felizmente, uma equipe de cientistas liderada pelo Prof. Shinya Maenosono do Instituto Avançado de Ciência e Tecnologia do Japão (JAIST) avançou e desenvolveu uma nova estratégia para separar rapidamente lisossomos intactos com alta pureza. Este estudo foi publicado em
ACS Nano e também incluiu o Prof. Kazuaki Matsumura e o Prof. Associado Yuichi Hiratsuka da JAIST, e o Prof. Tomohiko Taguchi da Universidade de Tohoku, Japão.
Sua estratégia está centrada no uso de nanopartículas híbridas magnético-plasmônicas (MPNPs) feitas de prata e uma liga de ferro-cobalto e cobertas por um composto chamado amino dextrano (aDxt). A base para essa abordagem é que as MPNPs cobertas com aDxt são naturalmente ingeridas pelas células por meio de "endocitose", que culmina dentro dos lisossomos. Uma vez que MPNPs suficientes tenham se acumulado dentro dos lisossomos, as células podem ser suavemente "esmagadas" e os lisossomos recuperados usando ímãs.
Para que este método funcione, é essencial que as MPNPs estejam localizadas apenas dentro dos lisossomos e não em outras organelas. É aqui que a imagem plasmônica é útil, pois a maneira distinta como as nanopartículas plasmônicas interagem com a luz as torna fáceis de visualizar com um microscópio óptico. Ao colorir cada tipo de organela na via endocítica de maneira diferente usando imunocoloração e verificando como a localização das MPNPs se sobrepõe a elas, os pesquisadores determinaram o tempo preciso que a maioria das MPNPs leva para atingir os lisossomos. Por sua vez, isso garante que o processo de separação produza amostras de lisossomo com alta pureza.
Depois, a equipe analisou os efeitos da temperatura e do tempo de separação magnética na composição proteica dos lisossomos extraídos. Seus resultados mostraram que a perda de proteína foi notavelmente rápida, mesmo em temperaturas tão baixas quanto 4°C. Felizmente, sua abordagem foi rápida o suficiente para extrair lisossomos intactos, como destaca o Prof. Maenosono:"Descobrimos que o tempo máximo necessário para isolar lisossomos após a ruptura celular foi de 30 minutos, que é substancialmente menor do que o tempo necessário usando técnicas baseadas em centrifugação, que normalmente requerem um tempo mínimo de separação de várias horas."
No geral, esta nova técnica ajudará os pesquisadores a explorar os metabólitos frágeis dos lisossomos e como eles mudam em resposta a estímulos. Por sua vez, isso abrirá caminho para novos insights sobre distúrbios relacionados à disfunção lisossomal. A esse respeito, o Prof. Maenosono comenta:"Dada a profunda relação dos lisossomos com muitos metabólitos celulares, é necessária uma compreensão mais profunda da função lisossomal para determinar sua regulação em diferentes estados celulares. Portanto, nossa técnica pode contribuir para uma melhor compreensão e tratamento de doenças lisossômicas no futuro." Além disso, essa nova abordagem pode ser modificada para extrair outras organelas além dos lisossomos. Esperamos que este estudo nos aproxime da compreensão do conteúdo das células em um grau muito maior.
+ Explorar mais Pesquisadores realizam perfis metabolômicos de lisossomos aumentados individualmente
