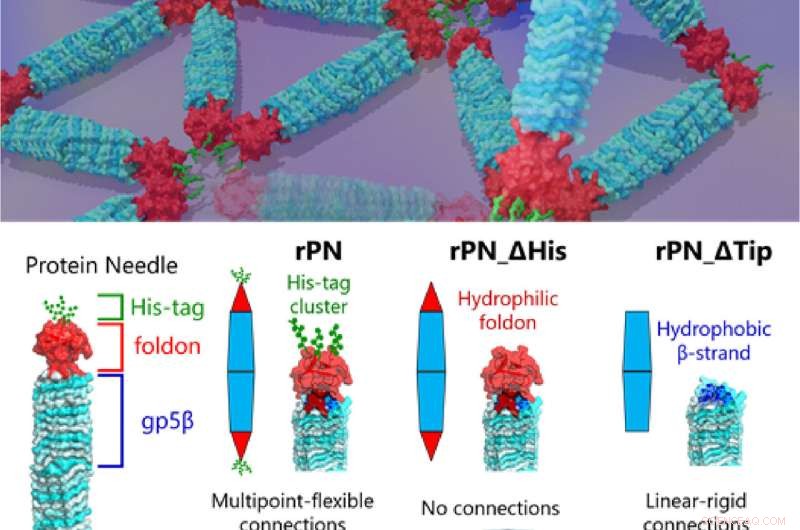
Fig. 1. Os cientistas há muito tentam decodificar as subestruturas complexas das proteínas. Agora, pesquisadores da Tokyo Tech finalmente lançaram luz sobre essa frente com a investigação da automontagem de proteínas projetadas usando agulhas de proteína. Crédito:Takafumi Ueno do Instituto de Tecnologia de Tóquio
A montagem de proteínas é essencial para a formação de estruturas biológicas ordenadas, mas imagine uma engenharia. Isso é exatamente o que os pesquisadores da Tokyo Tech conseguiram agora com agulhas de proteína. Ao regular as interações ponta a ponta dessas agulhas, elas permitiram sua automontagem em estruturas de treliça, estados monoméricos ordenados e conjuntos de fibras, abrindo caminho para a construção controlada de mais dessas arquiteturas de proteínas.
As proteínas são os blocos de construção básicos do nosso corpo. No entanto, suas estruturas moleculares e macroscópicas são complexas e variadas, com múltiplos padrões de dobramento e subestruturas. Os cientistas vêm tentando decodificar essas estruturas há algum tempo, e muito progresso foi feito graças à microscopia de fluorescência (FM), microscopia de força atômica (AFM) e AFM de alta velocidade (HS-AFM). No entanto, eles não foram capazes de observar diretamente os movimentos dinâmicos das proteínas durante a montagem. Isso se deve principalmente à estrutura intrincada das proteínas, que são muito pequenas para serem medidas com as técnicas existentes.
Uma equipe colaboradora de pesquisadores do Tokyo Institute of Technology (Tokyo Tech), Kyushu University, Nagoya University e National Institutes of Natural Sciences desenvolveram agora uma agulha de proteína anisotrópica (PN) especializada para ajudar a determinar a montagem de proteínas anisotrópicas semelhantes, dando-nos pistas sobre sua microestrutura e montagem.
O professor Takafumi Ueno, da Tokyo Tech, que liderou o estudo, explica a premissa de seu trabalho:"Nosso PN é uma proteína em forma de agulha composta pelo corpo rígido (β-hélice), a tampa terminal (foldon) e uma ligação (tag hexa-histidina, His-tag). Ao modificar esses PNs excluindo o motivo His-tag e a tampa dobrável, podemos produzir três tipos diferentes de PNs. Isso nos permitiu regular e observar diferentes padrões de montagem e como eles mudam , dando-nos pistas sobre a mecânica de diferentes interações proteína-proteína que encontramos na natureza." Os resultados deste estudo foram publicados na revista
Small. 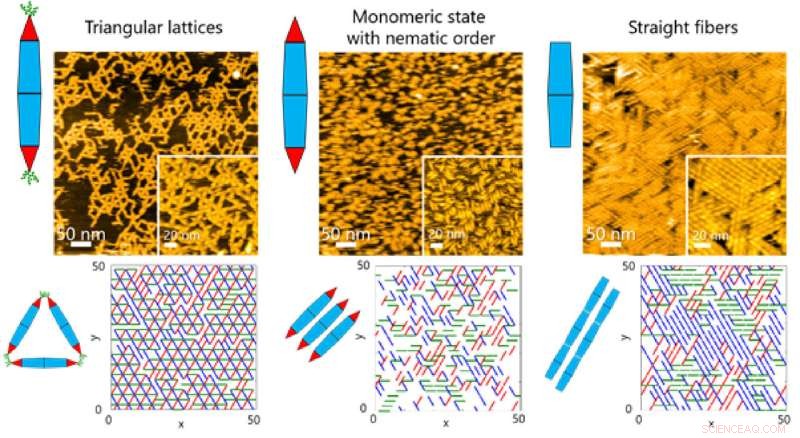
Fig. 2. As cadeias de proteínas básicas geralmente sofrem automontagem dinâmica para formar estruturas supramoleculares complexas. Cientistas da Tokyo Tech agora conseguiram explorar a dinâmica de montagem usando agulhas de proteína projetadas. Crédito:Takafumi Ueno do Instituto de Tecnologia de Tóquio
Em solução, os PNs formam espontaneamente uma estrutura altamente estável com um comprimento de cerca de 20 nm e uma largura de cerca de 3,5 nm, pequena o suficiente para rastrear o movimento rotacional de moléculas individuais, mas mecanicamente forte.
Nas superfícies, a equipe observou diferentes tipos de estruturas ordenadas à medida que as PNs se automontavam. Essas estruturas variavam de reticulados triangulares e estados monoméricos com ordem nemática (orientação unidimensional) a conjuntos de fibras (Figura 1).
Isso, por sua vez, permitiu que a equipe investigasse os processos dinâmicos envolvidos na montagem de proteínas por meio de uma combinação de HS-AFM e simulações (Figura 2). Os resultados revelaram que a formação da estrutura de reticulado triangular foi guiada pelos movimentos dinâmicos de PN, que contribuem para a formação de reticulados ordenados (Figura 3).
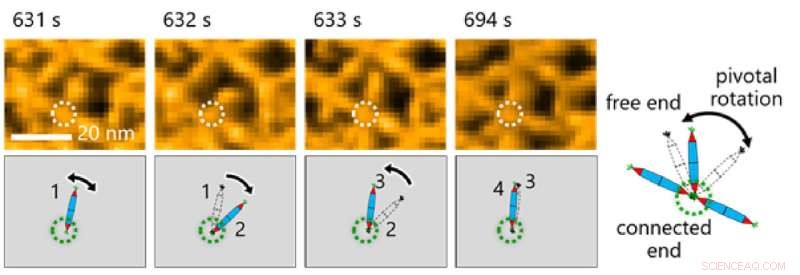
Fig. 3. Observar o movimento molecular dos PNs foi crucial para fazer observações neste estudo. Aqui, os pesquisadores notaram a rotação central em torno da interação His-tag entre as agulhas de proteína. Crédito:Takafumi Ueno do Instituto de Tecnologia de Tóquio
Essas descobertas entusiasmaram os pesquisadores, que estão contemplando suas possíveis ramificações. "Essas moléculas desempenham um papel tão crucial em sistemas biológicos que a compreensão de sua estrutura aprofundaria significativamente o campo. Por exemplo, poderíamos usar isso para lançar as bases para a construção de estruturas supramoleculares projetando os movimentos coletivos dinâmicos de proteínas. Esse conceito pode levar a a engenharia de materiais de folha biocompatíveis, transporte de drogas direcionadas e até nano-robôs baseados em proteínas", diz o Prof. Ueno.
+ Explorar mais Codificação de vias de montagem hierárquica de proteínas


