Influência de nanopartículas, íons circundantes na formação da estrutura de folha β em proteínas β amilóides
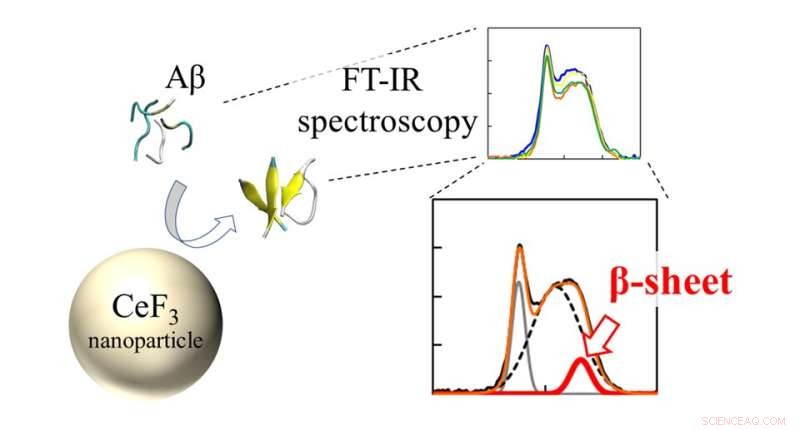
Espectros de infravermelho (FT-IR) e razão de folha β de peptídeos Aβ interagiram com NPs CeF3. O efeito das nanopartículas de CeF3 na estrutura da proteína beta amilóide é medido diretamente com espectroscopia FT-IR. A formação de estrutura secundária aparece como uma característica no espectro IR. Crédito:Masakazu Umezawa / Tokyo University of Science, tipo de licença:CC BY 4.0
A função e a atividade das proteínas são determinadas tanto por sua montagem quanto por sua estrutura secundária. Anormalidades relacionadas à agregação de proteínas ou à estrutura secundária podem levar a doenças neurodegenerativas. Em um novo estudo, uma equipe de pesquisa internacional revela como as nanopartículas de flúor, materiais usados em imagens in vivo, afetam a montagem e a estrutura da proteína β amilóide. Seus resultados apresentam um passo para um melhor tratamento e prevenção de distúrbios neurológicos como a doença de Alzheimer.
A auto-montagem, ou a associação de unidades individuais de um material em estruturas ou padrões ordenados, é um fenômeno de grande interesse de pesquisa para cientistas de materiais. Um exemplo proeminente de automontagem vem da automontagem de proteínas em sistemas biológicos. A função e a atividade das proteínas são governadas pelo seu estado de montagem. Além disso, a "estrutura secundária" da proteína, caracterizada por seu dobramento em estruturas, como uma folha β, também desempenha um papel. De fato, anormalidades nas estruturas secundárias de proteínas ou sua montagem podem levar a várias doenças neurodegenerativas, incluindo a doença de Alzheimer.
As nanopartículas (NPs) oferecem uma rota promissora para o tratamento e prevenção de tais doenças, permitindo uma entrega controlada e direcionada de medicamentos. Além disso, NPs inorgânicos, como NPs de flúor, são usados em aplicações de imagem cerebral. Em comparação com as NPs orgânicas, as NPs inorgânicas são consideradas melhores candidatas para o desenvolvimento de materiais de alta funcionalidade. Mas, há muita preocupação em relação à sua biotoxicidade. Embora suas interações com bioproteínas tenham sido estudadas, o mecanismo subjacente a essas interações não é bem compreendido.
Uma equipe internacional de cientistas da Tokyo University of Science (TUS) no Japão e da Nazarbayev University no Cazaquistão já abordou esta questão. Em seu estudo, que foi disponibilizado on-line em 2 de junho de 2022 e publicado na revista
ACS Applied Bio Materials em 20 de junho de 2022, a equipe investigou uma seção do peptídeo β amilóide (uma proteína encontrada nas placas que se formam no cérebro de pacientes com doença de Alzheimer) em uma solução com cerâmica de flúor (CeF
3 ) NP. O estudo foi liderado pelo Professor Associado Júnior Masakazu Umezawa e incluiu contribuições do Sr. Naoya Sakaguchi da TUS e dos Professores Assistentes Mehdi Amouei Torkmahalleh e Dhawal Shah da Universidade Nazarbayev.
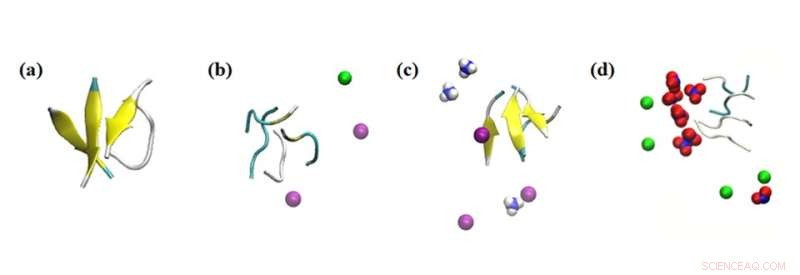
Instantâneos de simulação das interações do agregado peptídico com vários íons. Resultados da simulação do efeito de íons dentro de 0,1 nm sobre os peptídeos nos sistemas em estudo:(a) sem sal, (b) NaCl 0,15 M, (c) NH4Cl 0,15 M e (d) NaNO3 0,15 M. Coloração:folha beta =amarelo; Na+ =verde; NH4+ =azul e branco; Cl- =roxo; e NO3− =azul e vermelho. Crédito:Masakazu Umezawa / Tokyo University of Science, tipo de licença:CC BY 4.0
A equipe usou uma técnica chamada "espectroscopia infravermelha de transformada de Fourier" (FTIR) para monitorar diretamente o efeito da superfície NP nas ligações peptídicas. "Descobrimos que perto da superfície das nanopartículas, os peptídeos são mais propensos a formar folhas β. Isso ocorre como um efeito da hidrofobicidade. As partes do peptídeo que são repelidas pela solução aquosa aderem às nanopartículas e formam agregados mais facilmente", explica o Dr. Umezawa.
Além disso, a equipe investigou o efeito de outros íons circundantes na solução. "O que descobrimos foi muito surpreendente. Mesmo sem as nanopartículas, o ambiente afetou a taxa de formação da estrutura secundária", diz o Dr. Umezawa, "Esse efeito, resultante de uma combinação de interação eletrostática e ligação de hidrogênio, foi exagerado ao adicionar nanopartículas. Com uma escolha cuidadosa de íons e nanopartículas, a formação de folhas β pode ser suprimida ou promovida. Isso implica que o processo pode ser controlado e projetado para erradicar efeitos adversos."
Os resultados experimentais foram complementados com simulações de dinâmica molecular realizadas pela equipe da Universidade Nazarbayev. Isso, por sua vez, ajudou a projetar e orientar os experimentos, além de fornecer insights sobre os resultados.
Com essa compreensão mais profunda da interação entre proteínas e NPs, o estudo abre caminho para processos controlados de dobramento de proteínas. Com tal controle, quaisquer deformações de proteínas podem ser eliminadas, e interações positivas e mudanças estruturais podem ser promovidas. Isso poderia levar a um melhor protocolo de prevenção e tratamento da doença de Alzheimer e, eventualmente, a uma melhor qualidade de vida para os idosos.
+ Explorar mais Decodificando a dinâmica de montagem de proteínas com agulhas de proteínas artificiais

