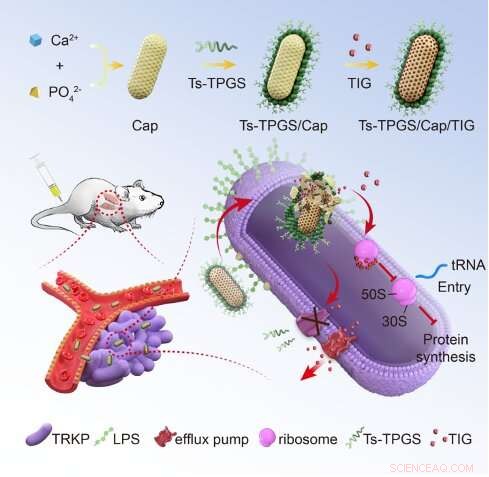
Representação esquemática da fabricação dos nanobastões e o mecanismo de superação da resistência à tigeciclina de TRKP. TIG:tigeciclina; Ts-TPGS/Cap/TIG:TPGS carregados com tigeciclina e nanobastões de fosfato de cálcio funcionalizados com S-tanatina; TRKP:pneumonia por Klebsiella resistente à tigeciclina. LPS:lipopolissacarídeo. Crédito:Escola de Medicina da Universidade de Zhejiang
O uso prolongado e excessivo de antibióticos causou a disseminação da resistência aos antibióticos. O processo demorado e custoso de desenvolvimento de novos antibióticos resulta no surgimento muito mais lento de novas drogas antibacterianas do que a resistência bacteriana. O surgimento de superbactérias vem crescendo e se tornando um desafio dominante na saúde humana. A tigeciclina é considerada a última linha de defesa para combater a Klebsiella pneumoniae multirresistente. No entanto, o aumento da utilização levou ao aumento da resistência aos medicamentos e ao fracasso do tratamento. A resistência à tigeciclina de Klebsiella pneumoniae continua sendo um problema global que precisa ser resolvido com urgência.
Em 29 de junho de 2022, o Prof. Du Yongzhong da Faculdade de Ciências Farmacêuticas da Universidade de Zhejiang, o Prof. Lu Xiaoyang e Jiang Saiping do The First Affiliated Hospital, Zhejiang University School of Medicine co-publicaram um artigo intitulado "TPGS-based and S- nanorods funcionalizados com tanatina para superar a resistência a drogas na pneumonia por Klebsiella" na revista
Nature Communications . Sua pesquisa demonstra que nanobastões funcionalizados com succinato de polietilenoglicol D-alfa tocoferol (TPGS) e peptídeo S-tanatina (Ts) com base em nanopartículas de fosfato de cálcio podem superar a resistência à tigeciclina da pneumonia por Klebsiella.
Primeiro, os pesquisadores prepararam os nanobastões de TPGS modificados com tigeciclina e funcionalizados com peptídeo S-tanatina, Ts-TPGS/Cap/TIG (TTCT), e caracterizaram as propriedades do TTCT. Eles descobriram que os nanorods Ts-TPGS/Cap preparados poderiam encapsular efetivamente o TIG e alcançar a liberação sustentada da droga. O TTCT com tamanho de partícula de ~25 nm não se desmonta em circulação e apresenta excelente estabilidade à temperatura ambiente.
Em seguida, os pesquisadores avaliaram a atividade antibacteriana do TTCT e exploraram os mecanismos subjacentes de superação da resistência. Eles descobriram que Ts-TPGS/Cap exibiu direcionamento e acúmulo aumentado em pneumonia por Klebsiella (KPN) e TRKP através da ligação entre Ts e LPS. O TPGS poderia exercer sua capacidade inibitória sobre a atividade das bombas de efluxo e a expressão de acrA, acrB e ramA em TRKP. Desta forma, a concentração de TIG dentro das bactérias foi significativamente maior no grupo TTCT do que nos outros grupos. A capacidade antibacteriana sinérgica entre Ts e TIG aumentou ainda mais a atividade antibacteriana TTCT, superando assim a resistência a drogas de TRKP.
Em camundongos com pneumonia, Ts-TPGS/Cap se acumulou especificamente nos pulmões. A administração de TTCT pode reduzir significativamente as contagens de glóbulos brancos e neutrófilos em amostras de sangue e diminuir os níveis de células totais e proteína C reativa (PCR) no líquido de lavagem broncoalveolar (LBA). Além disso, o TTCT foi capaz de melhorar a infiltração de neutrófilos nos pulmões e reduzir as colônias bacterianas de BALF, aparentemente aumentando as taxas de sobrevivência de camundongos com pneumonia causada por TRKP.
No geral, um sistema de entrega de nanodrogas baseado em TPGS e modificado com Ts foi projetado. Os nanobastões preparados podem aumentar o acúmulo de tigeciclina em bactérias através do efeito inibitório nas bombas de efluxo exercido pelo TPGS e a capacidade de direcionamento da S-tanatina para as bactérias. A capacidade antibacteriana sinérgica entre a S-tanatina e a tigeciclina aumenta ainda mais a atividade antibacteriana, superando assim a resistência à tigeciclina do TRKP. Os resultados fornecem uma estratégia terapêutica para doenças infecciosas causadas por bactérias gram-negativas MDR.
+ Explorar mais Novo candidato a medicamento combate mais de 300 bactérias resistentes a medicamentos
