Equipe modifica vírus em nanoescala para entregar drogas peptídicas às células, lenços de papel
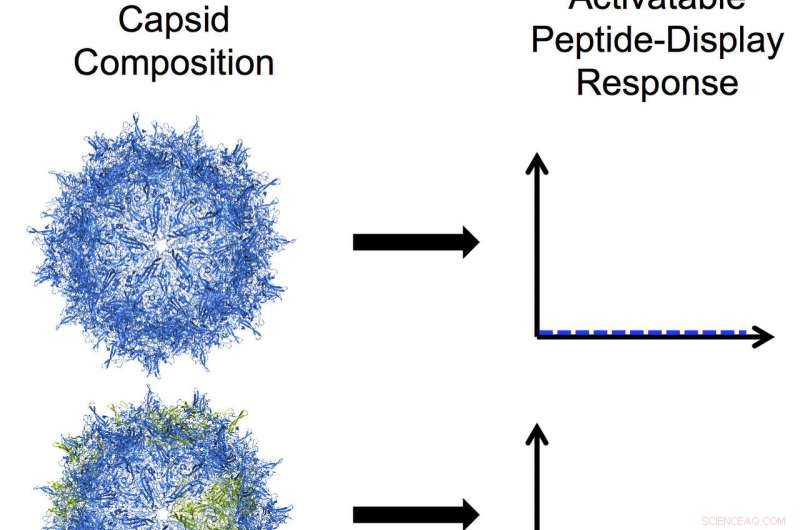 p Os bioengenheiros da Rice University desenvolveram vírus adeno-associados programáveis, modificando uma das três proteínas que se agrupam em uma casca resistente chamada capsídeo. Nesta ilustração, as subunidades azuis no capsídeo representam a proteína VP3 e as subunidades verdes representam um mutante truncado de VP2. De cima para baixo:um capsídeo somente de VP3 que não exibe nenhum peptídeo; um capsídeo em mosaico com uma maioria de VP3 e uma pequena quantidade do mutante VP2 que mostra um baixo nível de exibição de peptídeo ativável; um capsídeo em mosaico com quantidades iguais de mutante VP3 e VP2 que mostra um alto nível de exibição de peptídeo ativável; e um capsídeo mutante de VP2 homomérico com um alto nível de constante, exibição de peptídeo em escova. Crédito:Nicole Thadani / Rice University
p Os bioengenheiros da Rice University desenvolveram vírus adeno-associados programáveis, modificando uma das três proteínas que se agrupam em uma casca resistente chamada capsídeo. Nesta ilustração, as subunidades azuis no capsídeo representam a proteína VP3 e as subunidades verdes representam um mutante truncado de VP2. De cima para baixo:um capsídeo somente de VP3 que não exibe nenhum peptídeo; um capsídeo em mosaico com uma maioria de VP3 e uma pequena quantidade do mutante VP2 que mostra um baixo nível de exibição de peptídeo ativável; um capsídeo em mosaico com quantidades iguais de mutante VP3 e VP2 que mostra um alto nível de exibição de peptídeo ativável; e um capsídeo mutante de VP2 homomérico com um alto nível de constante, exibição de peptídeo em escova. Crédito:Nicole Thadani / Rice University
p Ao fragmentar uma proteína viral, Cientistas da Rice University descobriram um caminho em direção ao vírus, dispositivos em nanoescala que podem ser capazes de entregar drogas às células. p A proteína é uma das três que compõem a casca protetora, chamado de capsídeo, de vírus adeno-associados naturais (AAV). Ao fazer versões progressivamente menores da proteína, os pesquisadores fizeram capsídeos com habilidades únicas e aprenderam muito sobre os mecanismos de AAV.
p A pesquisa aparece na revista American Chemical Society
ACS Nano .
p O bioengenheiro de arroz Junghae Suh estuda a manipulação de AAVs não causadores de doenças para entregar cargas úteis como drogas de quimioterapia. Sua pesquisa levou ao desenvolvimento de vírus que podem ser desencadeados pela luz ou por proteases extracelulares associadas a certas doenças.
p Os AAVs são pequenos - cerca de 25 nanômetros - e contêm uma única fita de DNA dentro de cápsides resistentes que consistem em um mosaico de proteínas conhecidas como VP1, VP2 e VP3. AAVs têm sido usados para entregar cargas úteis de terapia genética, mas ninguém descobriu como os capsídeos de AAV se reconfiguram fisicamente quando acionados por estímulos externos, Suh disse. Esse foi o ponto de partida para seu laboratório.
p "Este vírus tem domínios intrínsecos de peptídeos (pequenas proteínas) escondidos dentro do capsídeo, "disse ela." Quando o vírus infecta uma célula, ele detecta o baixo pH e outros fatores endossômicos, e esses domínios de peptídeo saltam para a superfície do capsídeo do vírus.
p "Essa mudança conformacional, que denominamos uma 'exibição de peptídeo ativável, 'é importante para o vírus porque os domínios externalizados rompem a membrana endossômica e permitem que o vírus escape para o citoplasma, "Suh disse." Além disso, As sequências de localização nuclear nesses domínios permitem que o vírus transite para o núcleo. Acreditamos que poderíamos substituir essa funcionalidade por outra coisa. "
 p Nicole Thadani, deixou, e Junghae Suh, da Rice University, desenvolveram vírus adeno-associados programáveis que podem ser usados para fornecer drogas peptídicas. Crédito:Jeff Fitlow / Rice University
p Nicole Thadani, deixou, e Junghae Suh, da Rice University, desenvolveram vírus adeno-associados programáveis que podem ser usados para fornecer drogas peptídicas. Crédito:Jeff Fitlow / Rice University
p Suh e a autora principal e estudante de graduação do Rice, Nicole Thadani, acreditam que seus AAVs mutantes podem se tornar "nanopartículas de biocomputação" que detectam e processam entradas ambientais e produzem saídas controláveis. Modificar o capsid é a primeira etapa.
p Das três proteínas naturais do capsídeo, apenas VP1 e VP2 podem ser acionados para expor seus peptídeos funcionais, mas nenhum dos dois pode fazer um capsídeo por conta própria. VP3s mais curtos podem formar capsídeos por si próprios, mas não exibem peptídeos. Em AAVs naturais, As proteínas VP3 superam cada um de seus compadres 10 para 1.
p Isso limita o número de peptídeos que podem ser expostos, então Suh, Thadani e seus co-autores decidiram mudar a proporção. Isso os levou a truncar VP2 e sintetizar capsídeos de mosaico com VP3, resultando na alteração com sucesso do número de péptidos expostos. Com base em pesquisas anteriores, eles inseriram uma etiqueta hexahistidina comum que facilitou o monitoramento da exibição da superfície da região do peptídeo.
p "Queríamos aumentar a propriedade ativável da proteína além do que ocorre no capsídeo do vírus nativo, "Thadani disse." Em vez de exibir apenas cinco cópias do peptídeo por cápside, agora podemos exibir 20 ou 30 e obter mais da bioatividade que desejamos. "
p Eles então fizeram um VP2 truncado capaz de formar um capsídeo por conta própria. "Os resultados foram bastante surpreendentes, e não é óbvio para nós, "Suh disse." Cortamos esse componente VP2 o suficiente para formar o que chamamos de um capsídeo homomérico, onde todo o capsídeo é composto apenas dessa subunidade mutante. Isso nos deu vírus que parecem ter "escovas" de peptídeo que estão sempre na superfície.
p "Uma estrutura viral como essa nunca foi vista na natureza, "disse ela." Pegamos uma partícula com esse pincel de peptídeo, com pontas soltas em todos os lugares. Agora queremos saber se podemos usar essas pontas soltas para anexar outras coisas ou realizar outras funções. "
p Os AAVs homoméricos exibem até 60 peptídeos, enquanto os AAVs de mosaico podem ser programados para responder a estímulos específicos para células ou tecidos particulares e exibir um número menor desejado de peptídeos, disseram os pesquisadores.
p "Os vírus evoluíram para invadir células de forma muito eficaz, "Disse Suh." Queremos usar nosso vírus como uma plataforma de nanopartículas para entregar terapêuticas baseadas em proteínas ou peptídeos de forma mais eficiente nas células. Queremos aproveitar o que a natureza já criou, ajustá-lo um pouco e usá-lo para nossos propósitos. "

