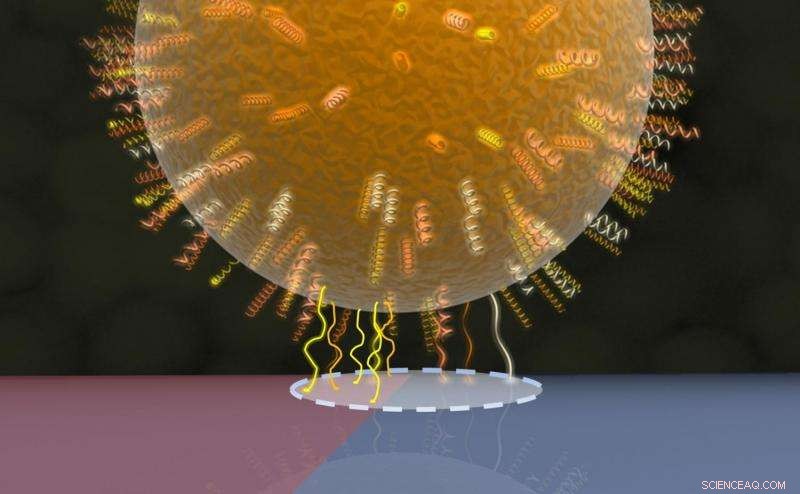
 p Modelo da área de contato bacteriana:as proteínas da parede celular em uma região circular (linha tracejada) fazem contato com a superfície subjacente, metade é mostrada em vermelho (região hidrofóbica com mais contatos de proteínas) e a outra metade em azul (região hidrofílica com menos contatos de proteínas). Crédito:AG Jacobs
p Modelo da área de contato bacteriana:as proteínas da parede celular em uma região circular (linha tracejada) fazem contato com a superfície subjacente, metade é mostrada em vermelho (região hidrofóbica com mais contatos de proteínas) e a outra metade em azul (região hidrofílica com menos contatos de proteínas). Crédito:AG Jacobs
p Uma equipe de físicos e biólogos que trabalha na Universidade de Saarland desenvolveu um método com o qual eles podem medir a área de contato entre uma bactéria e a superfície em que ela está "assentada". Interessantemente, e talvez contra a intuição, uma grande área de contato não significa necessariamente uma grande força adesiva. Acontece que características específicas da bactéria, que resultam em diferenças locais na composição das proteínas na parede celular, são as principais razões para as diferenças observadas na adesão. Esses resultados agora podem ser usados para otimizar materiais antibacterianos. O trabalho de pesquisa está sendo publicado hoje na revista.
Nanoescala . p As bactérias da espécie Staphylococcus aureus estão entre os patógenos mais difundidos e perigosos de nosso tempo. Uma das razões de sua eficácia é a capacidade de aderir a superfícies sintéticas e naturais, onde formam biofilmes muito persistentes. Esses biofilmes protegem eficazmente os patógenos individuais, tornando-os muito difíceis de remover de uma superfície. É por isso que sua presença em implantes médicos é tão temida e porque eles são uma das principais causas de infecção pós-operatória. Uma abordagem para prevenir a infecção é, portanto, prevenir a formação do biofilme. Mas, para poder influenciar o crescimento do biofilme, os cientistas precisam entender o mecanismo pelo qual as bactérias aderem às superfícies. Por exemplo, seria útil saber exatamente qual fração da área de superfície de uma única célula bacteriana está realmente em contato com a superfície. Contudo, como essas bactérias esféricas têm apenas um micrômetro de diâmetro (cerca de um centésimo da espessura de um fio de cabelo humano), era improvável que a microscopia de luz convencional pudesse ser usada para determinar a área de contato.
p A equipe da Saarland University liderada pela física experimental Professora Karin Jacobs e pelo microbiologista Professor Markus Bischoff, portanto, fez uso de outra propriedade da bactéria, a saber, que a força de adesão exibida por diferentes espécies de bactérias muitas vezes depende fortemente do tipo de superfície em que está situada. Por exemplo, as bactérias que foram o foco do presente estudo aderem muito mais eficazmente a superfícies fortemente hidrofóbicas do que a superfícies molháveis (hidrofílicas). Os pesquisadores, portanto, criaram uma superfície à base de silício que exibia ambas as propriedades - fortemente hidrofóbica em uma região, altamente molhável em outro - dentro de uma área extremamente pequena. A força adesiva exercida por bactérias individuais nesta superfície especialmente preparada foi então medida usando um microscópio de força atômica de varredura, conhecido como espectroscópio de força.
p O método envolve colocar uma única célula bacteriana em contato mínimo com a superfície e, em seguida, medir a força necessária para separar a bactéria dessa superfície. Esta é a força adesiva. Na parte hidrofóbica (literalmente 'ódio da água') da superfície, a força é aproximadamente dez vezes maior do que a necessária quando a célula bacteriana adere à região hidrofílica ('amante da água'). Este procedimento é então repetido com a célula bacteriana localizada sucessivamente mais perto do limite entre as regiões hidrofóbica e hidrofílica, em seguida, medindo a força com a bactéria localizada na própria fronteira e, finalmente, com a bactéria situada na zona puramente hidrofílica onde a força adesiva é mais fraca. Os dados de medição que relacionam a força adesiva de uma única célula à sua posição exata na superfície especialmente personalizada, e, portanto, para a molhabilidade da superfície, permitiu à equipe de pesquisa de Saarbrücken inferir o tamanho da área de contato entre a bactéria e a superfície. O método também pode ser usado para outras medições, como determinar a força adesiva de partículas coloidais, que também são de forma esférica.
p A equipe de pesquisa descobriu que o diâmetro da área de contato, que foi considerado circular, era da ordem de algumas dezenas a várias centenas de nanômetros (mil nanômetros equivalem a um milésimo de milímetro) e que o tamanho da área de contato pode variar significativamente entre diferentes células individuais da mesma espécie de Staphylococcus aureus. Para fins de comparação, um membro não patogênico do gênero Staphylococcus também foi estudado e adere muito menos fortemente à superfície do que o patógeno Staphylococcus aureus. É particularmente surpreendente que o tamanho da área de contato não tenha absolutamente nenhum efeito na força de adesão entre uma célula bacteriana e a superfície. Os pesquisadores também foram capazes de demonstrar que, apesar de sua forma esférica, as bactérias não podem ser descritas simplesmente como esferas duras quando interagem com uma superfície. Uma descrição mais precisa é pensar neles como bolas cobertas com um pano macio, revestimento desgrenhado e desigual das proteínas da parede celular e que este revestimento é o principal fator determinante da adesão entre a célula e a superfície. A pronunciada variabilidade local na força adesiva reflete as diferentes composições dos grupos de proteínas da parede celular, que determinam com que força uma região da superfície da célula é capaz de aderir a uma superfície.
p A abordagem usada no estudo pode, em princípio, ser aplicado a todas as outras espécies de patógenos bacterianos, independentemente de sua forma esférica ou em forma de bastonete. Os resultados podem abrir caminho para o desenvolvimento de superfícies cuja morfologia pode ser cuidadosamente ajustada para modificar essas forças adesivas, suprimindo assim a adesão de patógenos bacterianos indesejados, ou, alternativamente, encorajando a adesão de bactérias, como aqueles usados na eliminação de resíduos, cuja presença é desejada.
