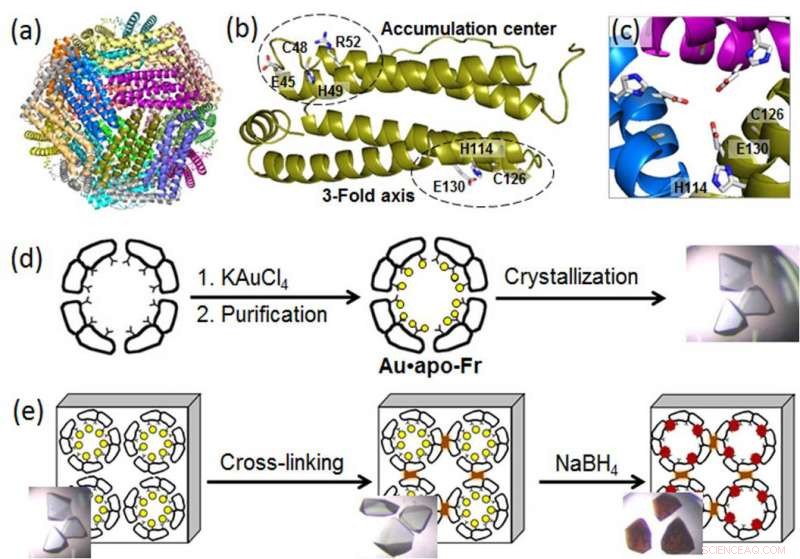
 p (a) Estrutura da molécula de ferritina 24-mer; (b) um monômero de ferritina com os locais de ligação de metal; (c) um canal de eixo simétrico de 3 vezes; (d) preparação e cristalização de ferritina contendo Au; (e) reticulação do cristal de ferritina e redução de íons Au (círculos amarelos) em átomos de Au (0) que formam nanoaglomerados (partículas marrons). Crédito:Instituto de Tecnologia de Tóquio
p (a) Estrutura da molécula de ferritina 24-mer; (b) um monômero de ferritina com os locais de ligação de metal; (c) um canal de eixo simétrico de 3 vezes; (d) preparação e cristalização de ferritina contendo Au; (e) reticulação do cristal de ferritina e redução de íons Au (círculos amarelos) em átomos de Au (0) que formam nanoaglomerados (partículas marrons). Crédito:Instituto de Tecnologia de Tóquio
p Cientistas do Instituto de Tecnologia de Tóquio usaram cristalografia de alta resolução para descobrir o mecanismo por trás da síntese assistida por proteínas de nanopartículas de ouro, fornecer uma plataforma para projetar nanomateriais sob medida para aplicação biomédica. p Em organismos vivos, íons de metal livres são armazenados e transportados através de proteínas montadas em estruturas altamente ordenadas, como gaiolas de proteínas, por meio de uma reação chamada biomineralização. Esta sofisticada estratégia biológica atraiu a atenção de biotecnologistas que especulam que gaiolas de proteínas de armazenamento de íons naturais podem ser usadas para cultivar nanopartículas de metal com as propriedades desejadas.
p Nanopartículas de ouro (AuNPs) são conhecidas por suas excelentes funções na catálise, bioimagem, entrega de drogas, e terapia; Portanto, a síntese de AuPs com tamanhos e formas controlados é muito importante para sua aplicação em nanomedicina. Em estruturas de proteína, AuNPs são formados por um processo sequencial envolvendo a deposição e aglomeração de ouro em pequenos nanoclusters que atuam como centros de nucleação para o crescimento de AuNP. Contudo, o mecanismo dinâmico subjacente à formação de nanoaglomerados de ouro em ambientes de proteínas permanece obscuro.
p Para divulgar os processos moleculares por trás do crescimento de AuNP em nanocages de proteína, um grupo de engenheiros biomoleculares do Instituto de Tecnologia de Tóquio, liderado por Takafumi Ueno, usaram cristalografia de alta resolução e analisaram a formação de nanoclusters de ouro em ferritina. Uma proteína universal de armazenamento de ferro intracelular produzida por quase todos os organismos vivos, a ferritina forma uma nanocage de 24 subunidades automontadas com dois sítios de ligação de metal específicos:o canal de eixo triplo e o centro de acumulação (Figura). Uma vez que os íons de ouro têm alta afinidade com o enxofre, os cientistas modificaram o centro de acúmulo, introduzindo um resíduo de cisteína contendo enxofre adicional para aumentar a absorção de ouro na gaiola de proteína. Então, eles reforçaram cristais de ferritina contendo Au por reticulação em glutaraldeído (Figura) para manter sua estrutura de rede. Essas modificações possibilitaram a redução dos íons de ouro nos cristais e a determinação das posições de ligação dos íons de ouro dentro da gaiola de ferritina por cristalografia de alta resolução.
p Na próxima etapa, os íons de ouro imobilizados foram reduzidos em átomos de Au (0) usando um agente redutor (NaBH4). Como resultado, os cientistas puderam observar que o ouro reduzido se aglomerou em nano aglomerados formados nos canais simétricos de 3 dobras e nos centros de acumulação de metal, que foi devido ao movimento gradual do ouro e mudanças conformacionais dos aminoácidos circundantes.
p Os resultados obtidos pelo Professor Ueno e seus colegas descobrem o mecanismo por trás da formação de nanoclusters de ouro que são esperados como centros de nucleação para o crescimento subsequente de AuNP no ambiente de proteína único, fornecendo uma plataforma para investigação futura de biomineralização e síntese de nanopartículas em andaimes biomoleculares.
