Cientistas dão um passo importante em direção a fábricas de produtos químicos em nanoescala sob medida
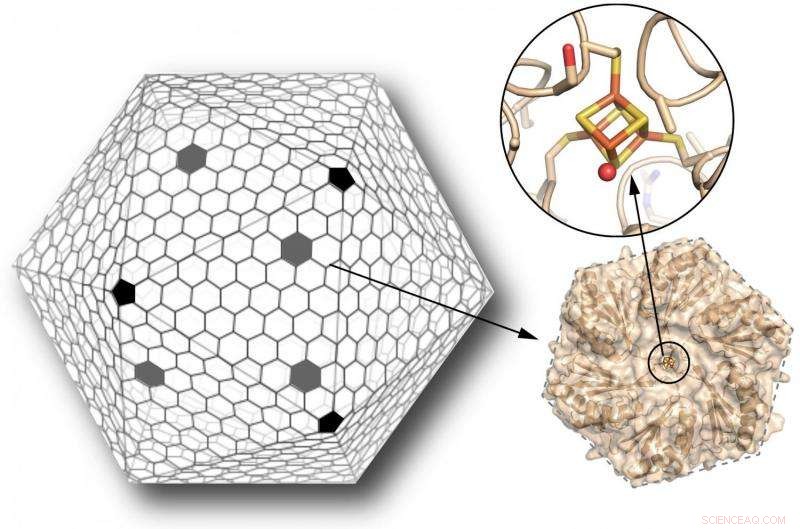 p A casca de um microcompartimento bacteriano (ou BMC) é composta principalmente de proteínas hexagonais, com proteínas pentagonais cobrindo os vértices, semelhante a uma bola de futebol (esquerda). Os cientistas desenvolveram uma dessas proteínas hexagonais, normalmente desprovido de qualquer centro de metal, para ligar um aglomerado de ferro-enxofre (varas laranja e amarelas, canto superior direito). Este cluster pode servir como um relé de elétrons para transferir elétrons através da camada. A introdução desta nova funcionalidade no shell de um BMC expande muito suas possibilidades como bio-nanorreatores feitos sob medida. Crédito:Clement Aussignargues / MSU; Cheryl Kerfeld e Markus Sutter / Berkeley Lab
p A casca de um microcompartimento bacteriano (ou BMC) é composta principalmente de proteínas hexagonais, com proteínas pentagonais cobrindo os vértices, semelhante a uma bola de futebol (esquerda). Os cientistas desenvolveram uma dessas proteínas hexagonais, normalmente desprovido de qualquer centro de metal, para ligar um aglomerado de ferro-enxofre (varas laranja e amarelas, canto superior direito). Este cluster pode servir como um relé de elétrons para transferir elétrons através da camada. A introdução desta nova funcionalidade no shell de um BMC expande muito suas possibilidades como bio-nanorreatores feitos sob medida. Crédito:Clement Aussignargues / MSU; Cheryl Kerfeld e Markus Sutter / Berkeley Lab
p Os cientistas, pela primeira vez, reprojetaram um bloco de construção de um nanocompartimento geométrico que ocorre naturalmente nas bactérias. Eles introduziram um sítio de ligação de metal em sua casca que permitirá que os elétrons sejam transferidos de e para o compartimento. Isso fornece uma funcionalidade totalmente nova, expandindo muito o potencial dos nanocompartimentos para servir como fábricas de produtos químicos feitos sob medida. p Os cientistas esperam adaptar esse novo uso para a produção de produtos químicos de alto valor, como medicamentos, sob demanda.
p Os robustos nanocompartimentos, que são conchas poliédricas compostas de lados em forma de triângulo e se assemelham a dados de 20 lados, são formados por centenas de cópias de apenas três tipos diferentes de proteínas. Suas contrapartes naturais, conhecidos como microcompartimentos bacterianos ou BMCs, envolvem uma grande variedade de enzimas que realizam uma química altamente especializada em bactérias.
p Pesquisadores do Laboratório Nacional Lawrence Berkeley do Departamento de Energia (Berkeley Lab) desenvolveram estruturas de concha sintética derivadas daquelas encontradas em uma forma de haste, bactéria que vive no oceano, Haliangium ochraceum, e reprojetou uma das proteínas do invólucro para servir de andaime para um aglomerado de ferro-enxofre encontrado em muitas formas de vida. O cluster é conhecido como "cofator" porque pode servir como uma molécula auxiliar nas reações bioquímicas.
p Os invólucros baseados em BMC são minúsculos, durável e naturalmente auto-montado e auto-reparável, o que os torna mais adequados para uma variedade de aplicações do que nanoestruturas totalmente sintéticas.
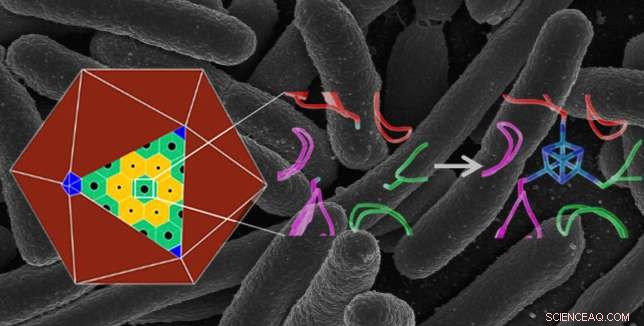 p Estrutura da proteína em escala atômica natural (meio) em um microcompartimento bacteriano poliédrico (à esquerda), e uma estrutura projetada (direita) que liga um aglomerado de ferro-enxofre (em azul), dando-lhe uma nova função. A proteína projetada foi produzida em E. coli bactérias - a imagem de fundo mostra uma imagem de micrografia eletrônica de varredura de E. coli . Crédito:Berkeley Lab, Instituto Nacional de Saúde
p Estrutura da proteína em escala atômica natural (meio) em um microcompartimento bacteriano poliédrico (à esquerda), e uma estrutura projetada (direita) que liga um aglomerado de ferro-enxofre (em azul), dando-lhe uma nova função. A proteína projetada foi produzida em E. coli bactérias - a imagem de fundo mostra uma imagem de micrografia eletrônica de varredura de E. coli . Crédito:Berkeley Lab, Instituto Nacional de Saúde
p "Esta é a primeira vez que alguém introduz funcionalidade em uma camada. Pensamos que a funcionalidade mais importante a ser introduzida era a capacidade de transferir elétrons para dentro ou para fora da camada, "disse Cheryl Kerfeld, um biólogo estrutural no Berkeley Lab e autor correspondente neste estudo. O grupo de pesquisa de Kerfeld se concentra em BMCs. Kerfeld tem nomeações conjuntas com a Divisão de Biofísica Molecular e Bioimagem Integrada (MBIB) do Berkeley Lab, UC Berkeley e o Laboratório de Pesquisa de Plantas MSU-DOE na Michigan State University (MSU).
p "Isso aumenta muito a versatilidade dos tipos de produtos químicos que você pode encapsular na casca e o espectro de produtos a serem produzidos, "ela disse." Normalmente, as conchas são consideradas simplesmente barreiras passivas. "
p Os pesquisadores usaram raios-X na Advanced Light Source (ALS) do Berkeley Lab para mostrar, em 3-D e em escala atômica, como o aglomerado de ferro-enxofre introduzido se liga à proteína projetada.
p O estudo agora está online no
Jornal da American Chemical Society .
p Enzimas dentro de BMCs naturais podem converter dióxido de carbono em compostos orgânicos que podem ser usados pelas bactérias, isolar compostos tóxicos ou voláteis da célula circundante, e realizar outras reações químicas que fornecem energia para a célula.
p Neste estudo, os pesquisadores introduziram o aglomerado de ferro-enxofre nos minúsculos poros do bloco de construção da casca. Esta proteína projetada serve como um relé de elétrons através da camada, que é a chave para controlar a reatividade química das substâncias dentro da casca.
p Clement Aussignargues, o principal autor do estudo e pesquisador de pós-doutorado no Laboratório de Pesquisa de Plantas MSU-DOE em Michigan, disse, "A beleza do nosso sistema é que agora temos todas as ferramentas, notavelmente a estrutura cristalográfica da proteína projetada, para modificar o potencial redox do sistema - sua capacidade de absorver elétrons (redução) ou liberar elétrons (oxidação).
p "Se pudermos controlar isso, podemos expandir a gama de reações químicas que podemos encapsular na casca. O limite dessas aplicações será o que colocamos dentro dos shells, não as próprias conchas. "
p Ele adicionou, "Criar um novo microcompartimento do zero seria muito, muito complicado. É por isso que estamos pegando o que a natureza colocou diante de nós e tentando adicionar ao que a natureza pode fazer. "
p Para projetar o site de ligação de metal, O grupo de Kerfeld primeiro teve que resolver as estruturas dos blocos de construção do nanocompartimento para usar como modelo para o design. Esses blocos de construção se auto-montam em conchas sintéticas, que medem apenas 40 nanômetros, ou bilionésimos de um metro, em diâmetro. A forma natural das conchas pode ser até 12 vezes maior.
p O cofator ferro-enxofre da proteína projetada, que foi produzido na bactéria E. coli, era muito estável, mesmo quando submetido a vários ciclos redox - uma característica essencial para aplicações futuras, Aussignargues disse. "A proteína projetada também era mais estável do que sua contraparte natural, o que foi uma grande surpresa, "ele disse." Você pode tratá-lo com coisas que normalmente fazem as proteínas se desintegrarem e se desenrolarem. "
p Um grande desafio no estudo foi preparar a proteína projetada em um ambiente livre de oxigênio para formar cristais minúsculos que melhor preservam sua estrutura e seu cofator para imagens de raios-X, Disse Kerfeld. Os cristais foram preparados em um porta-luvas selado a ar na MSU, congeladas, e, em seguida, enviado para estudos de raios-X no ALS do Berkeley Lab e no Stanford Synchrotron Radiation Lightsource (SSRL) do SLAC National Accelerator Laboratory.
p No trabalho de acompanhamento, a equipe de pesquisa está explorando como incorporar diferentes centros de metal em invólucros BMC para acessar uma gama diferente de reatividade química, ela disse.
p "Estou trabalhando para incorporar um centro de metal completamente diferente, que tem um potencial de redução muito positivo em comparação com o cluster ferro-enxofre, "disse Jeff Plegaria, um pesquisador de pós-doutorado no Laboratório de Pesquisa de Plantas da MSU-DOE que contribuiu para o estudo mais recente. "Mas é o mesmo tipo de ideia:conduzir os elétrons para dentro ou para fora do compartimento."
p Ele adicionou, "O próximo passo é encapsular proteínas que podem aceitar elétrons nas camadas, e usar isso como uma sonda para observar a transferência de elétrons de fora do compartimento para dentro. ”Isso aproximará os pesquisadores da criação de tipos específicos de produtos farmacêuticos ou outros produtos químicos.

