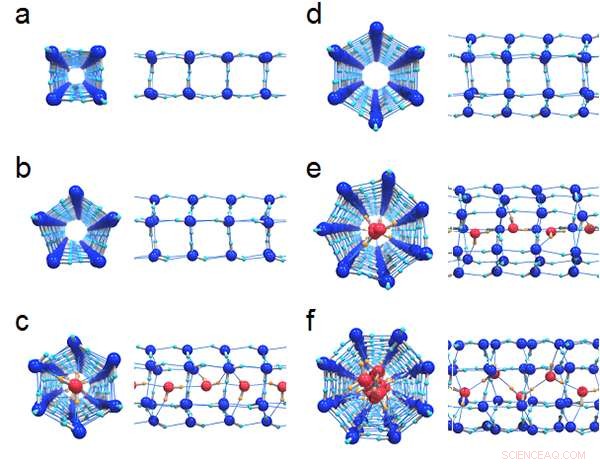
 p Figura 1:Estruturas de ligações de hidrogênio de seis gelos formados nos nanotubos:(a) (4, 0) gelo, (b) (5, 0) gelo e (c) preenchido (6, 0) gelo com um diâmetro de 1,11 nm, (d) (6, 0) gelo, (e) preenchido (7, 0) gelo e (f) preenchido (8, 0) gelo com um diâmetro de 1,25 nm. As vistas de topo e a vista lateral correspondente são desenhadas lado a lado. As moléculas centrais de água que formam uma cadeia nos gelos cheios são coloridas de vermelho para distingui-las dos anéis externos.
p Figura 1:Estruturas de ligações de hidrogênio de seis gelos formados nos nanotubos:(a) (4, 0) gelo, (b) (5, 0) gelo e (c) preenchido (6, 0) gelo com um diâmetro de 1,11 nm, (d) (6, 0) gelo, (e) preenchido (7, 0) gelo e (f) preenchido (8, 0) gelo com um diâmetro de 1,25 nm. As vistas de topo e a vista lateral correspondente são desenhadas lado a lado. As moléculas centrais de água que formam uma cadeia nos gelos cheios são coloridas de vermelho para distingui-las dos anéis externos.
p Muitos físicos não aceitam a ideia de que um limite de fase sólido-líquido pode terminar em um ponto crítico - um estado único em que duas fases perdem suas identidades separadas. Por que não? O livro didático oficial de Landau e Lifshitz diz que "podemos dizer apenas que uma propriedade de simetria particular existe ou não existe; ... O ponto crítico, portanto, não pode existir para tais fases." Mas desde 2001, a possibilidade do ponto crítico sólido-líquido foi relatada em estudos de simulação computacional de água em nanoporos. Na verdade, não há comprovação rigorosa da inexistência do ponto crítico sólido-líquido. p Kenji Mochizuki e Kenichiro Koga na Universidade de Okayama forneceram evidências inequívocas para apoiar o ponto crítico sólido-líquido para uma classe de água em nanotubos realizando simulações de dinâmica molecular extensas:separação macroscópica de fase sólido-líquido abaixo de uma temperatura crítica Tc, capacidade de calor divergente e compressibilidade isotérmica em torno de Tc, e os loci dos máximos da função de resposta (as linhas de Widom) acima de Tc.
p A Figura 1 mostra as estruturas de ligações de hidrogênio de seis cristais de gelo formados em nanotubos de carbono com diâmetros de 1,11 nm e 1,25 nm. Os pesquisadores descobriram que todos os limites da fase de primeira ordem entre o gelo e o líquido eventualmente deixaram de existir nos pontos críticos, como mostrado na Figura 2. O diagrama de fase T-P é muito diferente daquele da água em massa, onde as regiões de gelo são completamente rodeadas pelos limites da fase de primeira ordem (linhas pretas sólidas).
p Os pesquisadores também deram uma explicação microscópica para um simples, ainda sem resposta, pergunta:como a água líquida pode congelar continuamente em gelo cristalino? Eles encontraram flutuações dinâmicas de domínios microscópicos de água e gelo perto do ponto crítico - uma imagem microscópica de água no curso de congelamento ou derretimento gradual.
p Os pontos críticos em águas confinadas são onipresentes e podem ser encontrados em condições ambientais, ajustando o diâmetro do poro, e, portanto, uma das aplicações potenciais é usar as flutuações críticas ajustáveis para facilitar as reações químicas, mudanças estruturais nas moléculas biológicas, e formação de montagem de biomoléculas em água.
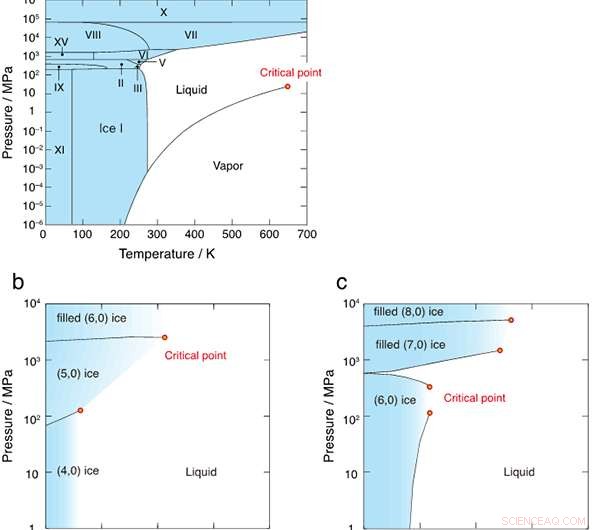 p Figura 2:Diagramas de fase de (a) água bruta, (b) água confinada no nanotubo de diâmetro de 1,11 nm, e (c) 1,25 nm. Os diagramas de fase de (b) e (c) são primeiramente revelados neste estudo. As regiões sólidas são coloridas em azul e os pontos críticos são indicados por círculos vermelhos.
p Figura 2:Diagramas de fase de (a) água bruta, (b) água confinada no nanotubo de diâmetro de 1,11 nm, e (c) 1,25 nm. Os diagramas de fase de (b) e (c) são primeiramente revelados neste estudo. As regiões sólidas são coloridas em azul e os pontos críticos são indicados por círculos vermelhos.

