 p Montagem de treliças de clatrina em diferentes superfícies. Crédito:(c) 2015 Nature Nanotechnology , DOI:10.1038 / NNANO.2015.206
p Montagem de treliças de clatrina em diferentes superfícies. Crédito:(c) 2015 Nature Nanotechnology , DOI:10.1038 / NNANO.2015.206
p (Phys.org) —As propriedades de emparelhamento de bases do DNA, combinados com nossas habilidades para criar DNA sintético em laboratório, levaram a avanços na arquitetura em nanoescala e projetos de dispositivos moleculares. Menos pesquisas foram feitas com proteínas, mesmo que as proteínas, como DNA, são feitos de subunidades individuais cujas propriedades químicas únicas podem ser exploradas para funcionalizar folhas de proteína ou imobilizar as proteínas em uma superfície. Certas proteínas têm propriedades desejáveis para dispositivos moleculares. p Um grupo de pesquisadores da Hannover Medical School, University College London, Georg August University, e o Centro de Microscopia em Nanoescala e Fisiologia Molecular do Cérebro na Alemanha mostraram que a clatrina, um complexo de proteínas formadoras de rede usado para o transporte de vesículas em células eucarióticas, pode ser imobilizado em uma variedade de superfícies e funcionalizado com nanopartículas e enzimas. Além disso, a estrutura de clatrina pode ser armazenada e reativada sem perder sua funcionalidade, tornando-o um substrato prático para dispositivos moleculares. O trabalho deles aparece em
Nature Nanotechnology .
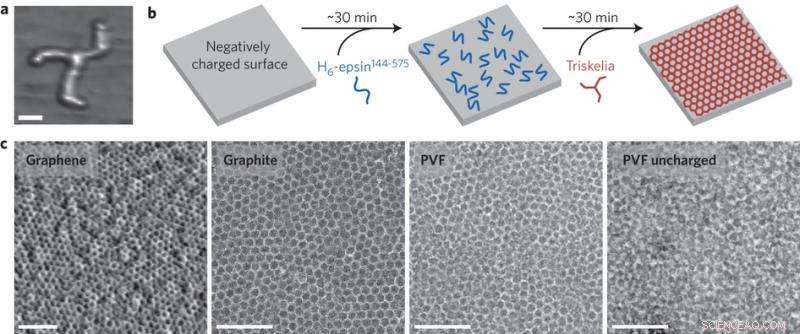
p A clatrina é empregada no transporte de vesículas através das membranas em células eucarióticas. Ele forma uma estrutura de rede que pode ser uma folha bidimensional ou uma gaiola tridimensional. A clatrina é composta por um complexo de proteínas de três pernas, conhecido como triskelion. A triskelia se auto-monta em treliças que envolvem uma membrana em uma gaiola poliédrica. O triskelion possui cadeias pesadas e cadeias leves. Uma rede pode ser feita de triskelia que são cadeias pesadas e leves ou apenas cadeias pesadas. Neste estudo, as cadeias leves são funcionalizadas com nanopartículas ou enzimas.
p Dannhauser, et al. descobriram que redes de clatrina bidimensionais se formarão em vários tipos de superfícies. Eles imobilizaram a clatrina usando uma porção de uma proteína adaptadora, H
6 -epsin. No corpo, a clatrina se liga às membranas por meio de proteínas adaptadoras, então, para fins de imobilização em uma superfície, Dannhauser, et al. testado se o mesmo mecanismo pode ser aplicado a uma variedade de superfícies no ambiente de laboratório. Eles produziram redes de clatrina imobilizadas em grafeno, polímeros, copo, e metais.
p A interação superfície-rede pode ser controlada usando NaSCN. O NaSCN é conhecido por impedir a montagem tridimensional da clatrina, então eles usaram para desmontar o bidimensional, rede ligada à superfície. Depois de tratar com NaSCN 0,05 M, a rede ficou desordenada. A remoção do NaSCN mostrou que algumas das características da rede permaneceram e o tratamento com mais triskelia causou a reforma da rede. Concentrações mais altas de NaSCN foram usadas para remover a rede completamente. Contudo, o H
6 O ligante de -epsina permaneceu intacto mesmo em concentrações mais altas de NaSCN, mostrando que o linker é altamente robusto enquanto a rede pode ser facilmente removida.
p Infelizmente, a rede de clatrina imobilizada só é estável por dezenas de minutos, o que é impraticável para uso como um dispositivo. Portanto, Dannhauser, et al. testou várias estratégias de reticulação. Eles descobriram que 4-azido-2, 3, 5, O éster succinimidílico do ácido 6-tetraoroenzo (ATFB) é um bom candidato para a reticulação. Ele liga covalentemente clatrina a H
6 -epsin. Adicionalmente, a rede pode ser desidratada pela primeira reticulação com glutaraldeído e, em seguida, usando acetato de uranila. Estudos AFM mostram que a atividade da rede pode ser restaurada após a reidratação. Crossliniking combinado com desidratação permitiu-lhes armazenar as redes por meses a fio.
p Finalmente, a rede de clatrina foi funcionalizada com nanopartículas de ouro e com uma coenzima chamada auxilina por meio da incorporação de cadeias leves modificadas a uma rede que consiste em cadeias pesadas. Estudos de imagem confirmaram a funcionalização das nanopartículas e da enzima. A auxilina é usada em células vivas junto com a enzima Hsc70 para remover redes de clatrina das membranas. Estudos preliminares mostraram que a auxilina parece manter sua atividade enzimática pela maneira como desmontou a rede de clatrina imobilizada. Embora estudos adicionais sejam necessários, este experimento demonstra que a montagem da rede pode ser funcionalizada com diversos tipos de partículas.
p Esta pesquisa analisa como a clatrina pode ser usada para dispositivos moleculares e nano montagem. Dannhauser, et al. demonstrar sua praticidade imobilizando a rede em várias superfícies, aumentando sua vida útil por meio de reticulação e desidratação, e funcionalizando-o com uma nanopartícula inorgânica e uma enzima. p © 2015 Phys.org
