
Esta micrografia eletrônica de transmissão mostra um nanoporo de estado sólido:O círculo branco no meio da imagem. A estrutura de aparência irregular resulta da natureza policristalina de uma película de ouro que foi evaporada na membrana de nitreto de silício (que não pode ser vista). Crédito:grupo Rant, TU MuenchenCopyright TU Muenchen
Um novo tipo de sensor, com base em poros em escala nanométrica em uma membrana semicondutora, é um passo mais próximo do uso prático em aplicações como a análise do conteúdo de proteínas de uma única célula. Pesquisadores pioneiros na tecnologia de sensor de nanoporos de molécula única na Technische Universität München (TUM) mostraram seu potencial por meio de uma sucessão de experimentos nos últimos anos. Agora, em colaboração com bioquímicos da Goethe University Frankfurt, eles foram capazes de avançar esse esforço além do que tinha sido um ponto difícil:aumentar a seletividade do sensor enquanto mantém sua sensibilidade a moléculas individuais. Eles relatam os últimos resultados em Nature Nanotechnology .
A pesquisa destinada a fabricar e controlar dispositivos de diagnóstico na escala de moléculas biológicas avançou a tal ponto que várias abordagens diferentes são vistas como competitivas para aplicação prática em um futuro relativamente próximo. A missão não é criar um universal, sensor de amplo espectro, mas sim uma tecnologia para detectar e identificar moléculas únicas de proteínas especificamente direcionadas - sem a necessidade de modificá-las adicionando "rótulos" bioquímicos. Essa tecnologia poderia ser usada, por exemplo, para acelerar a tradução de insights de genômica em conhecimento prático de proteômica. Isso é de interesse vital para a pesquisa médica e farmacêutica, bem como para estudos biológicos mais fundamentais. Outra aplicação potencial frequentemente mencionada é a detecção de agentes de guerra biológica.
Uma das abordagens mais promissoras é baseada na engenharia de um "checkpoint molecular, "uma passagem monitorada entre duas soluções de sal separadas por uma membrana artificial. Este chamado nanopore é dimensionado e moldado para que as moléculas passem uma de cada vez. A presença de uma molécula na via produz mudanças mensuráveis na condutividade elétrica através do nanopore, e refinamentos adicionais podem ajustar esse detector para torná-lo uma "verificação de identidade" altamente específica para moléculas-alvo. O que a colaboração Munique-Frankfurt permitiu é um método robusto e reversível para fazer esse ajuste fino:equipar um sensor nanoporo inorgânico com funcionalidade biológica ancorando receptores moleculares dentro dele. As equipes foram lideradas pelo Dr. Ulrich Rant, do Walter Schottky Institute da TUM e do TUM Institute for Advanced Study, e Prof. Dr. Robert Tampé do Instituto de Bioquímica da Goethe University Frankfurt e do Cluster of Excellence Frankfurt (CEF) Macromolecular Complexes.
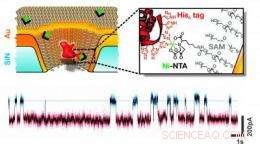
Esta ilustração esquemática mostra um nanoporo de estado sólido revestido de ouro que é quimicamente modificado com um único receptor capaz de se ligar a moléculas de proteína com um conjunto específico de resíduos de aminoácidos. Um traço de corrente vs. tempo exemplar mostra a ligação transitória de proteínas individuais. Crédito:grupo Rant, TU Muenchen, Copyright TU Muenchen.
"O que eu acho incrível sobre os nanoporos, "Rant diz, "é a relação custo-benefício:você já pode realizar experimentos de molécula única com equipamentos que valem apenas alguns milhares de euros. Se a tecnologia for mais comercializada, Tenho certeza de que os instrumentos podem ser vendidos pelo preço de um computador pessoal, potencialmente permitindo que as pessoas detectem moléculas individuais em casa. "
A fabricação desses dispositivos experimentais começou com um substrato de nitreto de silício com apenas 50 nanômetros de espessura; assim, a membrana era literalmente um chip semicondutor (embora não, claro, um circuito integrado). Ferramentas padrão da indústria de microeletrônica, litografia por feixe de elétrons e corrosão iônica reativa, foram usados para perfurar a membrana de nitreto de silício com nanoporos de 20 a 50 nm de diâmetro. A deposição de vapor foi usada para revestir os poros com titânio e ouro, e o metal, por sua vez, recebeu um revestimento químico auto-montado com uma camada molecular de espessura. Os nanoporos resultantes tinham uma forma cônica cônica com um diâmetro na extremidade estreita de cerca de 25 nm; ancorado na camada superficial havia um pequeno número de receptores bioquímicos projetados para capturar e imobilizar a proteína que daria ao sensor sua funcionalidade biológica. Para esses experimentos, os chips foram montados em uma câmara de medição com uma solução eletrolítica de cada lado; moléculas de proteína adicionadas a um lado da câmara foram impelidas através do nanopore por uma carga elétrica. Traços de mudanças na corrente elétrica produziram medições em tempo real de moléculas individuais à medida que passavam pelos nanoporos - ou permaneciam enquanto interagiam com a proteína imobilizada - e esses dados, por sua vez, forneceram a identificação positiva das moléculas-alvo.

A renderização deste artista ilustra como proteínas únicas são sondadas com um nanoporo projetado artificialmente em uma membrana de estado sólido metalizada. A proteína primária (vermelho escuro) ancorada dentro do poro se liga transitoriamente ao anticorpo anIgG (vermelho claro) que passa através do poro. O tempo de interação pode ser medido eletricamente (um exemplo de traço corrente x tempo é mostrado na parte superior da imagem); isso revela a função biológica do anticorpo. Um tapete de moléculas auto-montadas (cabelos brancos) é usado para revestir as paredes dos poros dourados, tornando a superfície biologicamente inerte. Crédito:Christof Hohmann, Excellence Cluster Nanosystems Initiative Munich (NIM), copyright NIM
Os pesquisadores foram capazes de detectar proteínas marcadas com histidina recombinante, e também para discriminar entre subclasses de anticorpos IgG naturais (de ratos e hamsters). No passado, este nível de seletividade só poderia ser alcançado às custas da sensibilidade de uma única molécula. Os resultados relatados em Nature Nanotechnology mostrar que esse obstáculo pode ser superado, e mais - que a abordagem é extremamente versátil. Como Rant explica, "O método que empregamos para ancorar proteínas únicas dentro do poro é bastante genérico e funciona para muitas proteínas recombinantes disponíveis. Portanto, é fácil dotar o nanoporo de estado sólido com a funcionalidade biológica desejada. Basta selecionar uma proteína adequada, que reconhece especificamente proteínas alvo de interesse, e usá-lo para sondar as proteínas à medida que elas passam ".
"O futuro continua empolgante, "Tampé diz, "porque a natureza está muito à nossa frente em termos de seletividade e especificidade. Portanto, mais melhorias são necessárias no campo dos sistemas sensoriais artificiais em nível molecular. A colaboração entre as equipes de Munique e Frankfurt representa um passo importante na tecnologia de biossensorial e nanodiagnóstico o nível de moléculas individuais. " Rant acrescenta, "A maior parte das pesquisas recentes sobre nanoporos foi direcionada para a detecção e sequenciamento de DNA. Espero que nossos resultados mostrem que os nanoporos têm o potencial de se tornarem ferramentas importantes para a pesquisa de proteínas também. E quem sabe? Talvez em breve veremos a introdução de nanoporos de proteínas sensores como instrumentos de diagnóstico para detectar marcadores de doenças de baixa abundância em amostras de pacientes. "