Forças dentro das moléculas podem fortalecer ligações extra-longas de carbono-carbono
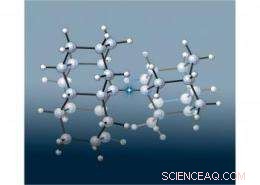 p Uma equipe de cientistas europeus e do SLAC juntou duas estruturas "diamondoides" minúsculas semelhantes a diamantes para criar a ligação carbono-carbono mais longa (destacada nesta imagem pela estrela) já vista em um alcano, uma classe de moléculas feitas apenas de carbono e hidrogênio conectadas por ligações covalentes simples. O que foi surpreendente, Contudo, foi que a molécula era muito mais estável do que o esperado, já que títulos mais longos são geralmente mais fracos. Os pesquisadores determinaram que as forças de atração entre os diamantóides aumentam a estabilidade dessa molécula. Imagem de Peter R. Schreiner, Universidade Justus-Liebig, Alemanha.
p Uma equipe de cientistas europeus e do SLAC juntou duas estruturas "diamondoides" minúsculas semelhantes a diamantes para criar a ligação carbono-carbono mais longa (destacada nesta imagem pela estrela) já vista em um alcano, uma classe de moléculas feitas apenas de carbono e hidrogênio conectadas por ligações covalentes simples. O que foi surpreendente, Contudo, foi que a molécula era muito mais estável do que o esperado, já que títulos mais longos são geralmente mais fracos. Os pesquisadores determinaram que as forças de atração entre os diamantóides aumentam a estabilidade dessa molécula. Imagem de Peter R. Schreiner, Universidade Justus-Liebig, Alemanha.
p (PhysOrg.com) - A força de uma ligação química entre os átomos é a base fundamental para a estabilidade e reatividade de uma molécula. Ajustar a força e acessibilidade da ligação pode mudar dramaticamente as propriedades de uma molécula. Por exemplo, a força de um vínculo está diretamente relacionada ao seu comprimento:esticar um vínculo além de seu comprimento normal o torna mais fraco. p Mas uma nova pesquisa feita por uma equipe de duas universidades europeias e do SLAC National Accelerator Laboratory mostra que as forças de atração entre outras partes de uma molécula podem fazer uma ligação esticada unindo dois átomos de carbono muito mais estável do que o esperado. Este resultado deve levar a melhorias na forma como os cientistas projetam novas moléculas, materiais e catalisadores.
p “Nós fornecemos uma compreensão de por que as moléculas com ligações excepcionalmente longas não precisam ser necessariamente instáveis, ”Disse Jeremy Dahl, um cientista do Stanford Institute for Materials &Energy Science (SIMES), um instituto administrado conjuntamente pelo SLAC e pela Universidade de Stanford. Os colaboradores foram Peter R. Schreiner, da Universidade Justus-Liebig, na Alemanha, e Andrey A. Fokin, do Instituto Politécnico de Kiev, na Ucrânia. Os resultados são publicados hoje em
Natureza .
p Embora aplicável a todos os tipos de moléculas, a nova pesquisa envolve alcanos, uma classe de moléculas compostas apenas de átomos de carbono e hidrogênio conectados por ligações covalentes simples, e diamondoides, que são diamantes do tamanho de uma molécula lançados pelos pesquisadores do SIMES. Etano, propano e octano são alcanos familiares que têm uma estrutura de dois, três e oito átomos de carbono, respectivamente, todos unidos por ligações simples. Os átomos de carbono nos diamantóides extremamente rígidos são arranjados na mesma forma tetraédrica do diamante.
p Em sua nova pesquisa, os cientistas juntaram pares de diamondoides para criar três novos alcanos que tinham uma ligação carbono-carbono ultralonga no meio. Para acomodar os diamondoides volumosos, a ligação central teve que se esticar muito além do comprimento normal da ligação carbono-carbono de 1,54 angstroms. (Um angstrom, ou Å, é um décimo de nanômetro.) Uma das novas moléculas tinha a ligação carbono-carbono mais longa já medida em um alcano:1,704Å.
p Surpreendentemente, essas novas moléculas diamondoides duplas revelaram-se muito mais estáveis do que o esperado. Pesquisas anteriores feitas por outros grupos mostraram que um alcano com uma ligação carbono-carbono de 1,65Å sobreviveu menos de uma hora a 167C (333F). Em contraste, a ligação carbono-carbono central em duas das novas moléculas de diamondoides ligados quebrou somente depois de ser aquecida acima de 300C (572F). O terceiro, com a ligação carbono-carbono de 1,704Å, durou até ser aquecido a 220C (428F).
p “Com base apenas no comprimento da ligação carbono-carbono, Eu esperava que essas moléculas diamantóides fossem muito menos estáveis do que provaram ser, ”Schreiner disse. “Algo mais precisava estar acontecendo para manter essas novas moléculas juntas”.
p O que fez a diferença? Estrutura de cristal de raios-X, ressonância magnética nuclear, e estudos termogravimétricos feitos por colegas europeus de Dahl mostraram que mesmo com as ligações esticadas, forças de atração entre os dois diamondoides os estavam puxando para mais perto. Essas forças de atração são geralmente vistas entre moléculas separadas, onde são chamadas de forças de van der Waals em homenagem ao físico holandês que as descreveu pela primeira vez em 1873. "Os cientistas geralmente não consideram as atrações de van der Waals ao analisar a estabilidade de uma única molécula, mas agora parece que eles deveriam, ”Dahl disse.
p As descobertas da pesquisa do grupo foram apoiadas por cálculos sofisticados que permitiram aos cientistas ligar e desligar as forças de atração ao avaliar as estabilidades das novas moléculas.
p Schreiner acrescentou que esta descoberta pode explicar porque a análise convencional prevê que alcanos ramificados - que contêm grandes grupos de átomos ligados à estrutura do alcano - sejam muito menos estáveis do que realmente são, e por que os diamantóides têm pontos de fusão muito mais altos do que o esperado.
p Esses resultados são os mais recentes em várias descobertas de pesquisas interessantes e aplicações para diamondoides desde que Dahl e seu colega Robert Carlson desenvolveram uma maneira de isolar quantidades significativas deles do petróleo bruto em 2003.
p Entre suas propriedades interessantes, diamondoides emitem elétrons com extrema eficiência. Em trabalho publicado na Science em 2007, Zhi-Xun Shen, cientistas do SIMES, Wanli Yang e Nick Melosh - além de Dahl, Carlson e o Grupo Schreiner - mostraram que os diamantóides emitem elétrons prontamente em uma faixa de energia muito estreita, uma propriedade que pode melhorar as capacidades de imagem de vários tipos de microscópios eletrônicos, bem como a padronização de feixe de elétrons usada para fazer chips de computador.
p Diamondoides também são altamente personalizáveis, o que significa que diferentes variedades podem ser produzidas e modificadas para atender a diferentes especificações:cristais tridimensionais para aplicações que requerem um material em pó, filmes bidimensionais para o revestimento de outros materiais, e possivelmente até nanofios unidimensionais para transferir carga ou luz.
p “Esses últimos resultados mostram que fazer moléculas em novas formas e tamanhos pode levar a descobertas surpreendentes, ”Dahl disse.
