Capa online - um mesoscópio em miniatura computacional (CM2). Crédito da imagem:Xue et al., Avanços da Ciência, doi:10.1126 / sciadv.abb7508
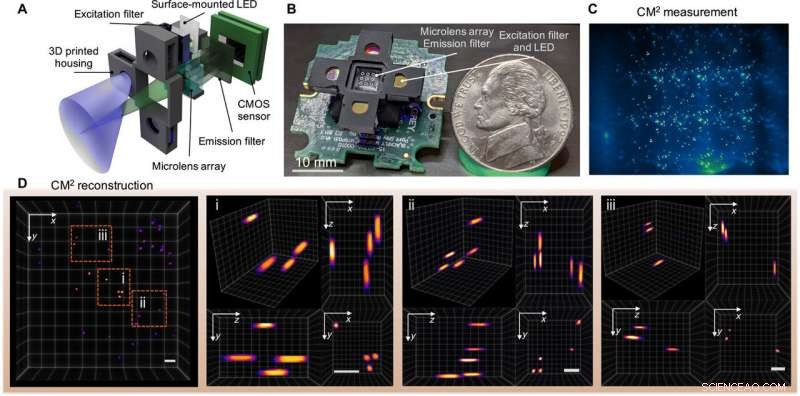
A fotografia da capa do artigo online sobre Avanços da Ciência esta semana exibe imagens de fluorescência com um mesoscópio em miniatura computacional (CM 2 ) A técnica de imagem por fluorescência é uma ferramenta essencial para biólogos e neurocientistas; Contudo, microscópios convencionais e microscópios miniaturizados (miniscópios) são restringidos por produto de largura de banda espacial limitada - uma medida da capacidade de informação de um sistema óptico, profundidade de campo rasa e incapacidade de resolver emissores distribuídos tridimensionais (3-D). Para superar os limites existentes, Yujia Xue e uma equipe de pesquisadores em engenharia elétrica e de computação, biologia, neuropotônica e engenharia biomédica na Universidade de Boston, NÓS., desenvolveu um mesoscópio leve e compacto conhecido como mesoscópio em miniatura computacional (CM 2 )
A nova plataforma integrou uma microlente para imagem e uma matriz de LED para excitação dentro da mesma configuração. O dispositivo executou imagens 3-D de disparo único e facilitou um ganho de campo de visão de 10 vezes e uma melhoria de profundidade de campo de 100 vezes, em comparação com miniscópios existentes. Xue et al. testou o dispositivo com contas fluorescentes e fibras ao lado de experimentos fantasma para medir os efeitos de espalhamento em massa e fluorescência de fundo. A equipe discute a praticidade deste mesoscópio para amplas aplicações em biomedicina e registro neural 3-D.
Microscopia de fluorescência avançada
A microscopia de fluorescência é uma técnica fundamental na biologia fundamental e na neurociência de sistemas. Desenvolvimentos tecnológicos recentes visam superar barreiras de escala para investigar neurônios individuais de apenas alguns mícrons de tamanho. Por exemplo, macroscópios, microscópios de mesolens e microscópios de dois fótons começaram a preencher essa escala; Contudo, o desenvolvimento de tais sistemas de imagem é limitado por aberrações geométricas dependentes de escala de elementos ópticos. O campo de visão alcançável (FOV) também é limitado pela profundidade de campo rasa do sistema em muitas aplicações de bioimagem. Os pesquisadores também estão focados em miniaturizar a tecnologia para permitir imagens in vivo em animais que se comportam livremente. Por exemplo, microscópios miniaturizados conhecidos como 'miniscópios' ganharam acesso sem precedentes a sinais neurais, embora os sistemas permaneçam restritos por sua ótica, muito parecido com suas contrapartes de microscopia de fluorescência. Xue et al. portanto, introduziu e demonstrou um microscópio computacional em miniatura (CM 2 ) com grande escala, Medições de fluorescência 3-D em um compacto, plataforma leve.
Fluorescência 3D CM2 de disparo único. (A) O CM2 combina uma óptica MLA e excitação de matriz de diodo emissor de luz (LED) em uma plataforma compacta e leve. (B) Imagem do protótipo CM2 (os fios elétricos e o driver do sensor são omitidos). Crédito da foto:Yujia Xue, Universidade de Boston. (C) Medição de CM2 em partículas fluorescentes de 100 μm suspensas em resina transparente. (D) Vista projetada do volume reconstruído CM2 (7,0 mm por 7,3 mm por 2,5 mm) e três regiões de zoom com vistas ortogonais. Barras de escala, 500 μm. CMOS, semicondutor de óxido metálico complementar. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508 
A equipe usou ótica simples na configuração para realizar melhorias no produto de largura de banda espacial (SBP) e recursos de imagem 3-D sem a necessidade de varredura mecânica. A técnica ultrapassou os limites físicos da óptica integrada ao projetar em conjunto o hardware e o algoritmo. O CM 2 método de imagem combinou vários recursos diferentes de imagem microscópica, como imagem integral, microscopia de campo de luz e imagem de abertura codificada. Em seu mecanismo de ação, o microscópio coletou uma única medição 2-D usando uma matriz de microlentes (MLA) para a reconstrução computacional subsequente da distribuição de fluorescência 3-D.
O CM 2 usou a matriz de microlentes como o único elemento de imagem e permitiu que a configuração superasse os limites do campo de visão (FOV) impostos pelas lentes objetivas dos microscópios convencionais. O CM 2 algoritmo resolveu o problema de deconvolução 2-D-para-3-D para fornecer reconstruções resolvidas em profundidade. Xue et al. explicou o princípio do CM 2 capacidade de imagem 3D de disparo único, fazendo uma analogia com a multiplexação por divisão de frequência (FDM). A equipe então quantificou a resolução alcançável do CM 2 calculando a função de transferência de modulação 3-D (MTF) do sistema e analisando a resolução lateral.
Caracterização do princípio de imagem do CM2, variação de deslocamento, e resolução. (A) O CM2 produz PSFs de matriz que variam axialmente para obter o seccionamento óptico. O cisalhamento axial nos focos laterais é bem caracterizado pelo modelo geométrico apresentado no estudo. O PCC dos PSFs escaneados axialmente quantifica a resolução axial esperada. EM, emissão. (B) O 3D MTF (mostrado em escala logarítmica) mostra que o CM2 captura informações de frequência axial estendida e aumenta o SBP do sistema. O suporte do MTF experimental coincide com a teoria (em curva tracejada-pontilhada). O ângulo de cada "banda" inclinada no MTF é definido pela localização angular das microlentes αMLA correspondentes (em linha tracejada). (C) A variância do deslocamento lateral é caracterizada pelo PCC dos PSFs escaneados lateralmente. O PSF no FOV central (marcado por linhas de limite laranja) contém 3 × 3 focos; o PSF no FOV externo (marcado por linhas de limite azuis) contém 2 × 3 ou 3 × 2 focos; o PSF no canto FOV (marcado por linhas de limite amarelas) contém 2 × 2 focos. (D) A resolução em diferentes regiões do FOV é caracterizada pela reconstrução de um objeto pinhole de 5 μm usando o modelo invariante ao deslocamento do CM2. A largura lateral total na metade do máximo (FWHM) é consistentemente abaixo de 7 μm. O FWHM axial é de ~ 139 μm no FOV central e degrada para ~ 172 e ~ 189 μm nos FOVs externos e de canto, respectivamente. (E) Geometria para geração de imagens de um alvo fluorescente inclinado. (F) Medição CM2 bruta. (G) MIPs do volume reconstruído (8,1 mm por 5,5 mm por 1,8 mm). Os recursos de 7 μm (grupo 6, elemento 2) pode ser resolvido como mostrado na projeção xy com zoom. A capacidade de corte axial é caracterizada pela projeção xz, validando a resolução axial dependente do tamanho do recurso. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508 
Xue et al. aproximou a formação da imagem do CM 2 configuração usando um modelo invariante de deslocamento em fatias. Eles caracterizaram a resolução e a variação de deslocamento lateral da configuração antes da imagem experimental e geraram imagens de um alvo de resolução fluorescente para validar a resolução lateral do CM 2 . Eles validaram as observações usando medições simuladas por Zemax para encontrar um bom acordo entre as simulações e os experimentos. A nova plataforma permitiu aos cientistas localizar emissores fluorescentes distribuídos em um grande volume. Eles testaram o desempenho do CM 2 em amostras com um tamanho de recurso semelhante a um único neurônio. Durante esses experimentos, o CM 2 algoritmo era tolerante a degradações de sinal, como relações de sinal-ruído reduzidas para permitir alta qualidade, reconstrução de campo de visão completo. A equipe comparou o CM 2 reconstrução e uma pilha axial adquirida por uma lente objetiva para demonstrar a precisão da localização de disparo único de partículas individuais.
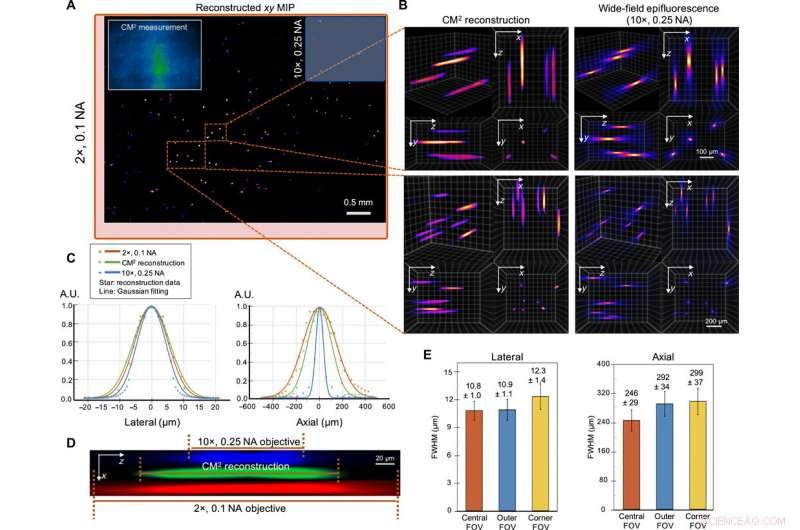
Imagem 3D de disparo único de partículas fluorescentes de 10 μm em um volume claro. (A) xy MIP do volume reconstruído medindo 5,7 mm por 6,0 mm por 1,0 mm. Inserção superior esquerda:medição CM2 bruta. O FOV do CM2 é comparável a uma lente objetiva de 2 × (caixa delimitadora vermelha) e é ~ 25 × mais largo do que a lente objetiva de 10 × (caixa delimitadora azul). (B) Zoom-in da reconstrução 3D CM2 comparada pela pilha axial tomada por um 10 ×, Lente objetiva de 0,25 NA. (C) Seções transversais laterais e axiais da partícula de 10 μm recuperada. Ao comparar com as medições da microscopia de fluorescência de campo amplo padrão, o CM2 recupera fielmente o perfil lateral da partícula e obtém o seccionamento de profundidade de uma única vez. A.U., unidades arbitrárias. (D) vista em seção transversal xz de uma partícula fluorescente reconstruída, em comparação com a pilha axial adquirida das lentes objetivas 2 × e 10 ×. (E) Para caracterizar as variações espaciais da reconstrução, as estatísticas dos FWHMs laterais e axiais das partículas reconstruídas são plotadas para o centro, exterior, e canto FOV. A largura lateral muda apenas ligeiramente (~ 0,9%) no FOV externo, mas aumenta no FOV de canto (~ 13,9%). O alongamento axial degrada de ~ 246 μm no FOV central para ~ 292 e ~ 299 μm nas regiões FOV externas e de canto, respectivamente. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508
Experimentos com fibras fluorescentes em uma superfície curva e em fantomas de dispersão controlada.
Em seguida, os cientistas testaram a capacidade de obter imagens de amostras volumétricas fluorescentes complexas em fibras fluorescentes espalhadas em uma superfície curva impressa em 3-D. imitando o perfil da superfície de um córtex de camundongo, abrangendo um amplo campo de visão e uma profundidade estendida. O algoritmo recuperou com precisão as estruturas em foco e resolveu para o objeto 3-D, enquanto resolve a maioria das fibras individuais. A equipe conduziu experimentos em oito fantasmas de imagem para testar o desempenho do CM 2 sob dispersão em massa e forte fluorescência de fundo. Durante os experimentos, eles semearam todos os fantasmas com a mesma concentração de partículas fluorescentes alvo e creditaram as diferenças na reconstrução ao espalhamento em massa e à fluorescência de fundo. A equipe então incluiu partículas fluorescentes de fundo de 1,1 µm para imitar fontes fluorescentes não resolvíveis comumente vistas em amostras biológicas; como neutropils no cérebro. Eles quantificaram o nível de espalhamento para cada fantasma, realizou a reconstrução 3-D para cada fantoma de espalhamento e executou todas as desconvoluções usando a mesma configuração computacional. A faixa de profundidade de reconstrução estimada variou com as variações de superfície presentes em cada fantoma.

Reconstrução de fibras fluorescentes. O arquivo do filme visualiza a reconstrução volumétrica de fibras fluorescentes em uma superfície curva. Para comparação, o mapa de profundidade estimado a partir da pilha focal de um microscópio de epi-fluorescência de campo amplo com um 2 ×, A lente objetiva 0.1 NA é exibida. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508
Desta maneira, Yujia Xue e seus colegas desenvolveram um novo sistema de imagem fluorescente miniaturizado para permitir imagens 3-D mesoscópicas de disparo único. O mesoscópio em miniatura computacional (CM 2 ) método de imagem de fluorescência integrada e os módulos de excitação na mesma plataforma compacta. A equipe apresentou as simulações e experimentos para estabelecer o mecanismo de ação e capacidade de imagem 3-D do CM 2 . Eles simularam imagens de redes vasculares de todo o cérebro e os resultados primários foram promissores. O CM 2 protótipo ainda não é comparável a aplicações in vivo montadas em cabeçotes (em modelos animais) em laboratórios de neurociência, embora a equipe preveja otimizar o dispositivo para imagens in vivo corticais completas em ratos que se movem livremente. O dispositivo de imagem pode ser melhorado ainda mais com novos desenvolvimentos em hardware e algoritmos para abrir novas e excitantes oportunidades dentro do registro neural in vivo e aplicações biomédicas.
© 2020 Science X Network