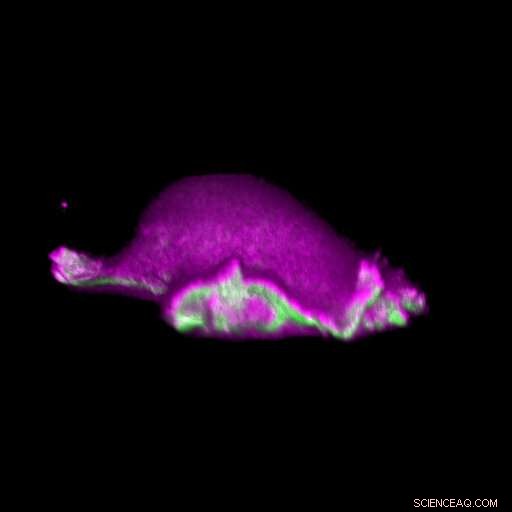
 p Uma célula avança:as proteínas I-BAR (rosa) se acumulam no local em que suas curvas lamelipódicas. Deste modo, a célula pode organizar localmente a proteína actina (verde) e gerar um ciclo lamelipodial. Crédito:Isabell Begemann, Milos Galic
p Uma célula avança:as proteínas I-BAR (rosa) se acumulam no local em que suas curvas lamelipódicas. Deste modo, a célula pode organizar localmente a proteína actina (verde) e gerar um ciclo lamelipodial. Crédito:Isabell Begemann, Milos Galic
p Quando uma célula individual é colocada em uma superfície nivelada, não fica parado, mas começa a se mover. Este fenômeno foi observado pelo biólogo celular britânico Michael Abercrombie já em 1967. Desde então, os pesquisadores têm se esforçado para entender como as células realizam essa façanha. Isso é muito conhecido:as células formam os chamados lamelipódios - protuberâncias celulares que crescem e se contraem continuamente - para se propelirem em direção a pistas de sinalização, como atrativos químicos produzidos e secretados por outras células. Quando esses sinais externos estão faltando - como na observação de Abercrombie - as células começam a procurá-los ativamente. Ao fazer isso, eles usam padrões de pesquisa que também podem ser observados em tubarões, abelhas ou cães. Eles se movem temporariamente em uma direção, Pare, mexa-se no local por um tempo, e então continue se movendo em outra direção. Mas como as células mantêm a direção de seu movimento por um longo período de tempo? p Pesquisadores do Cluster de Excelência Cells-in-Motion da Universidade de Münster (Alemanha) agora relatam uma resposta a esta pergunta. Eles descobriram que a geometria da membrana pode desencadear ciclos lamelipodiais subsequentes:forças mecânicas causam a geração da curvatura da membrana onde certas proteínas que reconhecem essa geometria se congregam. Essas proteínas, por sua vez, permitir que a célula forme os lamelipódios. "A curvatura, gerado durante a retração predetermina o crescimento do próximo ciclo lamelipodial. É assim que o mecanismo se reativa constantemente, "explica o biólogo Dr. Milos Galic, líder do grupo júnior de pesquisa no Cluster of Excellence, e autor sênior do estudo. Quando os sinais externos estão faltando, uma célula não apenas para e marca o tempo - ela se dirige momentaneamente em uma direção e patrulha com eficiência seu ambiente. O estudo foi publicado no
Física da Natureza Diário.
p O ponto de partida do estudo foi uma observação surpreendente feita durante a análise de imagens microscópicas. Os pesquisadores estavam investigando como as células formavam lamelipódios e, em consequência, como o movimento e a forma das células mudaram. Eles descobriram que os lamelipódios evoluíram em uma ampla gama de tamanhos e tinham tempos de vida muito diferentes.
p "Nos dados, não conseguimos reconhecer nenhum padrão recorrente no crescimento e contração dos lamelipódios, "diz a autora principal, Dra. Isabell Begemann, uma bióloga que realizou o estudo como parte de sua tese de doutorado. Os pesquisadores foram capazes de determinar que os locais de extensão subsequente dos lamelipódios ocorreram sempre que a membrana celular desenvolveu uma forte curvatura. Eles, portanto, hipotetizaram que um mecanismo ligado a essas curvaturas pode determinar ciclos de movimento contínuo e, em consequência, persistência de movimento.
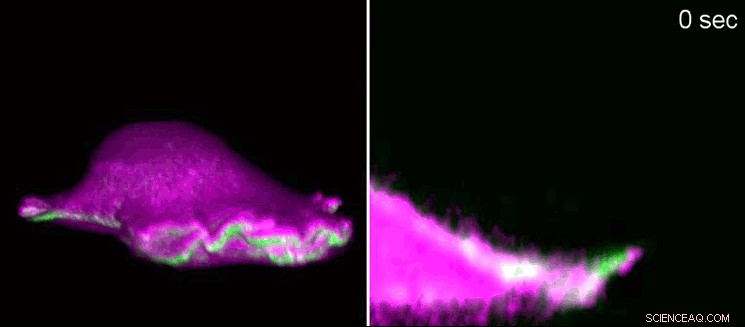 p Um fibroblasto de um camundongo avança usando um “lamelipódio”. À esquerda, visão lateral em 3D, à direita, uma seção transversal ampliando para o lamelipódio. As proteínas I-BAR (rosa) se acumulam no início do lamelipódio como resultado da curvatura da membrana celular. Como consequência, a célula pode organizar localmente a proteína actina (verde) e o lamelipódio volta a crescer. Usando microscopia de fluorescência de folha de luz de rede, os pesquisadores mostraram as estruturas minúsculas em 3D. Os lamelipódios têm uma altura de 100 a 200 nanômetros. Crédito:Isabell Begemann, Milos Galic
p Um fibroblasto de um camundongo avança usando um “lamelipódio”. À esquerda, visão lateral em 3D, à direita, uma seção transversal ampliando para o lamelipódio. As proteínas I-BAR (rosa) se acumulam no início do lamelipódio como resultado da curvatura da membrana celular. Como consequência, a célula pode organizar localmente a proteína actina (verde) e o lamelipódio volta a crescer. Usando microscopia de fluorescência de folha de luz de rede, os pesquisadores mostraram as estruturas minúsculas em 3D. Os lamelipódios têm uma altura de 100 a 200 nanômetros. Crédito:Isabell Begemann, Milos Galic
p Biólogos, bioquímicos e físicos trabalharam juntos para investigar essa ideia. Eles primeiro desenvolveram biossensores a fim de rotular locais altamente curvos na membrana celular, e os visualizou por vários meios de microscopia de alta resolução. Para este fim, eles conectaram moléculas fluorescentes com os chamados domínios I-BAR. Essas são regiões de proteínas em forma de banana cujo lado carregado positivamente se liga à membrana celular carregada negativamente - mas apenas quando a membrana é curva.
p Aproveitando esses biossensores, os pesquisadores conseguiram demonstrar que as proteínas sensíveis à curvatura se acumulam nos locais onde o lamelipódio está se contraindo. Depois de enriquecido, essas proteínas induzem forças protuberantes na célula através da proteína actina, que desencadeia o crescimento do lamelipódio. Em uma próxima etapa, os pesquisadores desenvolveram um modelo matemático que reconstitui o mecanismo e o simula no computador usando várias combinações de parâmetros. Comparar as previsões derivadas do modelo matemático com dados de imagens experimentais complementares reforçou ainda mais os resultados encontrados até agora.
p Os pesquisadores encontraram evidências da presença do mecanismo de motilidade identificado em modelos de cultura de células, por exemplo, em células do tecido conjuntivo derivadas de camundongos, nas células dos vasos sanguíneos humanos do cordão umbilical, e também em células imunes humanas - ou seja, um tipo de célula que realmente se move livremente dentro do organismo. Finalmente, os pesquisadores também queriam saber quais efeitos o mecanismo proposto tinha no padrão de motilidade de uma célula.
p "Regulamos negativamente as proteínas I-BAR, permitindo-nos invadir o sistema de auto-organização da célula, "diz Milos Galic. Sem o mecanismo, a célula ainda consegue se mover, mas a área de pesquisa torna-se substancialmente menor. Paralelo a este mecanismo, existem outras máquinas que se entrelaçam - mas o mecanismo tem influência no padrão de motilidade de uma célula. Os resultados do estudo poderiam, no futuro, ajudam a responder a questões fundamentais sobre processos em organismos que envolvem células que se movem livremente.

