Crédito:ACS
Pela primeira vez, um químico da Universidade de Michigan usou emaranhamento quântico para examinar estruturas de proteínas, um processo que requer apenas um pequeno número de fótons de luz.
Tradicionalmente, os cientistas usaram poderosos microscópios de varredura a laser para estudar proteínas em escala molecular. Mas os lasers tradicionais apresentam dois problemas. Primeiro, a intensidade do laser pode danificar a amostra examinada. Segundo, o laser explode a amostra com fótons, que então se dispersam para longe do alvo.
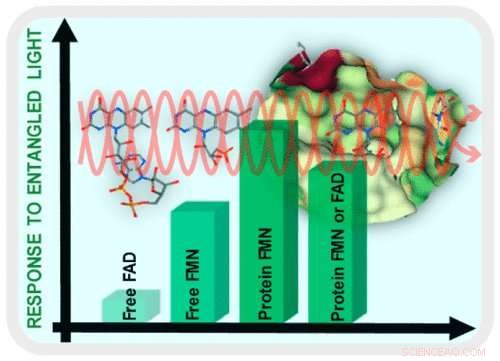
Em vez de, O professor de química da U-M, Theodore Goodson, e o método de sua equipe de usar o emaranhamento quântico usa apenas um pequeno número de fótons para aprender sobre as moléculas. Nesse caso, a equipe estudou flavinas, um grupo de enzimas essenciais para o metabolismo energético do corpo.
Emaranhamento quântico é a ideia de que as propriedades de um par ou grupo de partículas dependem umas das outras, mesmo que as partículas estejam separadas por grandes distâncias. Por exemplo, se uma partícula está girando no sentido horário, o outro em seu par girará no sentido oposto, se eles estão emaranhados. Essa relação persiste mesmo que as partículas estejam a milhares de quilômetros de distância, Goodson disse.
"Acontece que, se você tiver fótons emaranhados, que o alto grau de correlação pode interagir com moléculas de proteínas de uma maneira diferente do que se elas não estivessem emaranhadas, "Goodson disse." Somos capazes de sondar as propriedades das proteínas com um número extremamente pequeno de fótons. "
Os fótons emaranhados são produzidos pelo envio de luz laser através de um cristal do tamanho da ponta de uma unha. Quando a luz viaja através do cristal de uma certa maneira, alguns dos fótons ficam emaranhados. Esses pares emaranhados são então usados para examinar as moléculas-alvo.
Esses fótons excitam estados eletrônicos na proteína. Com base na radiação eletromagnética que a molécula emite quando excitada pelos fótons, Goodson pode determinar propriedades específicas sobre a molécula, um método chamado espectroscopia.
O número de fótons necessários para a espectroscopia de fótons emaranhados é extraordinariamente baixo em comparação com os métodos tradicionais de espectroscopia a laser.
"Você pode imaginar fazer uma investigação onde pode usar 10 ordens de magnitude menos fótons para sondar a característica particular de um material, amostra biológica, ou uma quantidade muito pequena de um produto químico em uma superfície? ", disse Goodson.
Usando este método, Goodson e sua equipe foram capazes de ver uma nova interação dentro de uma proteína flavina. Olhando para as flavoproteínas, a equipe foi capaz de ver as diferenças em sua espectroscopia usando emaranhamento quântico em comparação com o uso de luz clássica.
O método abre novos caminhos para a microscopia de imagem, Goodson disse. Observar fótons emaranhados interagindo com moléculas em proteínas pode ensinar aos cientistas algo novo sobre os estados eletrônicos dessas moléculas.
"Por exemplo, na fotossíntese, quando os fótons fornecem energia para o centro de reação fotossintética, o mecanismo desse efeito pode ser aprimorado com o uso de luz quântica, "disse ele." Com um processo de excitação de fótons emaranhados, pode ser possível otimizar, bem como melhorar os processos de transferência de energia em sistemas biológicos. Isso pode levar a novas informações sobre os processos químicos e biológicos nesses complexos biológicos que ocorrem naturalmente. "
Próximo, o grupo espera estudar as propriedades de moléculas orgânicas e biológicas usando fótons emaranhados em um microscópio. Os co-autores do estudo incluem Juan Villabona-Monsalve e Oleg Varnavski no Departamento de Química da U-M e Bruce Palfey no Departamento de Química Biológica da U-M.