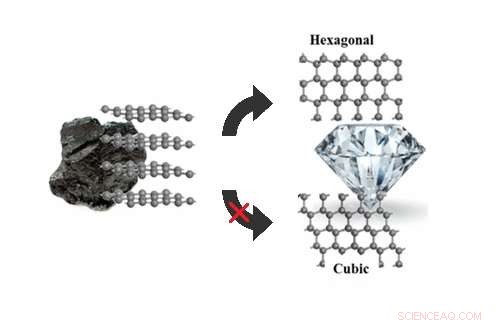
Simulações estocásticas de caminhada na superfície podem explicar por que o grafite se transforma em hexagonal, não cúbico, diamante sob pressões de 5-20 gigapascais. Crédito:Xie et al. © 2017 American Chemical Society
(Phys.org) —Os pesquisadores finalmente responderam a uma pergunta que iludiu os cientistas por anos:quando expostos a pressões moderadamente altas, por que o grafite se transforma em diamante hexagonal (também chamado de lonsdaleita) e não no diamante cúbico mais familiar, como previsto pela teoria?
A resposta em grande parte se resume a uma questão de velocidade - ou em termos de química, a cinética da reação. Usando um novo tipo de simulação, os pesquisadores identificaram os caminhos de menor energia na transição grafite-diamante e descobriram que a transição para o diamante hexagonal é cerca de 40 vezes mais rápida do que a transição para o diamante cúbico. Mesmo quando o diamante cúbico começa a se formar, uma grande quantidade de diamante hexagonal ainda está misturada.
Os pesquisadores, Yao-Ping Xie, Xiao-Jie Zhang, e Zhi-Pan Liu na Fudan University e na Shanghai University em Shanghai, China, publicaram seu estudo sobre as novas simulações da transição grafite-diamante em uma edição recente da Jornal da American Chemical Society .
"Este trabalho resolve o enigma de longa data de por que o diamante hexagonal é preferencialmente produzido a partir de grafite em vez do diamante cúbico no início da formação do diamante, "Liu disse Phys.org . "Considerando que o grafite para o diamante é um protótipo de transição sólido para sólido, o conhecimento aprendido com este trabalho deve beneficiar enormemente a compreensão da física e da química de sólidos de alta pressão. "
Grafite, diamante hexagonal, e o diamante cúbico são todos alótropos de carbono, o que significa que são feitos de átomos de carbono dispostos de maneiras diferentes. O grafite consiste em camadas empilhadas de grafeno, cujos átomos estão dispostos em uma estrutura semelhante a um favo de mel. Uma vez que os átomos de carbono no grafeno não estão totalmente ligados, o grafeno é macio e descama facilmente, tornando-o ideal para uso como grafite de lápis.
Ambos os tipos de diamante, por outro lado, consistem em átomos de carbono que têm no máximo quatro ligações, o que explica por que o diamante é tão difícil. No diamante cúbico (o tipo normalmente encontrado em joias), as camadas são todas orientadas na mesma direção. Em diamante hexagonal, as camadas são orientadas alternadamente, dando-lhe uma simetria hexagonal.
Sob altas pressões de mais de 20 gigapascais (quase 200, 000 vezes a pressão atmosférica), teoria e experimento concordam que o grafite se transforma em diamante cúbico, com algum diamante hexagonal misturado. Mas sob pressões de menos de 20 gigapascais, as simulações sempre previram que o diamante cúbico deveria ser o produto preferido, em contraste com experimentos.
Essas simulações são baseadas na previsão de que, a essas pressões, menos energia é necessária para formar o núcleo de nucleação de diamante cúbico, ou núcleo - o ponto de partida do crescimento do diamante - do que formar o núcleo hexagonal do diamante. Uma vez que formar este núcleo é a etapa que mais consome energia de todo o processo, segue-se que a formação de diamante cúbico deve ser termodinamicamente mais favorável do que o diamante hexagonal.
Mas uma grande desvantagem dessas simulações é que elas não levam em consideração as interfaces entre o grafite e os núcleos do diamante:uma incompatibilidade de rede entre as duas superfícies pode induzir uma energia de deformação que pode interferir na estabilidade do diamante em crescimento.
Usando uma nova simulação chamada caminhada de superfície estocástica, os pesquisadores no novo estudo poderiam explorar mais profundamente todas as interfaces possíveis e identificar sete delas que correspondem às estruturas intermediárias de menor energia na transição grafite-diamante.
Geral, os resultados mostram que a interface entre o grafite e o núcleo do diamante hexagonal é menos tensionada e mais estável do que a interface com o núcleo do diamante cúbico. Levar em conta a estabilidade dessas interfaces pode finalmente explicar por que o diamante hexagonal se forma muito mais fácil e rapidamente do que o diamante cúbico em pressões moderadas.
Os pesquisadores acrescentaram que, embora o diamante cúbico possa parecer mais desejável do que o hexagonal para a pessoa média, ambos os materiais têm suas vantagens.
"Embora o diamante cúbico seja familiar na vida cotidiana e seja um material altamente útil, diamante hexagonal também pode ser muito útil, "Liu disse." Por exemplo, foi previsto pela teoria ser ainda mais difícil do que o diamante cúbico. Enquanto o diamante hexagonal (lonsdaleita) pode ser encontrado em meteoritos, a produção de grandes cristais hexagonais de diamante não foi alcançada na experiência. Seria de esperar, portanto, que grandes cristais de diamante hexagonal, se produzido, seria ainda mais precioso do que o diamante cúbico. "
No futuro, os pesquisadores estão planejando melhorar ainda mais as simulações, incorporando técnicas de redes neurais, bem como usando big data.
© 2017 Phys.org