Os produtos químicos antifúngicos mais poderosos do mundo fazem com que os patógenos fúngicos se autodestruam
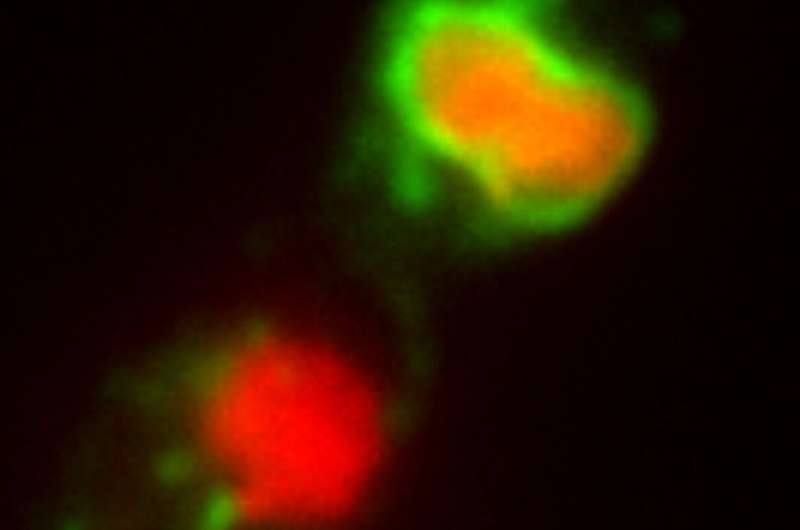 Um autofagossomo (verde) no processo de "comer" um núcleo (vermelho) em uma célula de Z. tritici tratada com azol. Imagem fornecida pelo coautor Dr. Martin Schuster. Crédito:Dr. Martin Schuster
Um autofagossomo (verde) no processo de "comer" um núcleo (vermelho) em uma célula de Z. tritici tratada com azol. Imagem fornecida pelo coautor Dr. Martin Schuster. Crédito:Dr. Martin Schuster Os cientistas descobriram que a classe de antifúngicos mais utilizada no mundo causa a autodestruição dos patógenos. A investigação liderada pela Universidade de Exeter poderia ajudar a melhorar as formas de proteger a segurança alimentar e as vidas humanas.
As doenças fúngicas são responsáveis pela perda de até um quarto das colheitas mundiais. Eles também representam um risco para os seres humanos e podem ser fatais para aqueles com sistema imunológico enfraquecido.
Nossas armas mais fortes contra doenças fúngicas das plantas são os fungicidas azólicos. Estes produtos químicos representam até um quarto do mercado mundial de fungicidas agrícolas, avaliado em mais de 3,8 mil milhões de dólares por ano. Os azóis antifúngicos também são amplamente utilizados como tratamento contra fungos patogénicos que podem ser fatais para os seres humanos, o que aumenta a sua importância na nossa tentativa de controlar doenças fúngicas.
Os azóis têm como alvo enzimas na célula patogênica que produzem moléculas semelhantes ao colesterol, chamadas ergosterol. O ergosterol é um componente importante das biomembranas celulares. Os azóis esgotam o ergosterol, o que resulta na morte da célula patogênica. No entanto, apesar da importância dos azóis, os cientistas sabem pouco sobre a real causa da morte do patógeno.
Em um novo estudo publicado na Nature Communications , Cientistas da Universidade de Exeter descobriram o mecanismo celular pelo qual os azóis matam fungos patogênicos. O artigo é intitulado "Azóis ativam vias de morte celular programadas tipo I e tipo II em fungos patogênicos de culturas". Os co-autores são o Dr. Martin Schuster e o Dr. Sreedhar Kilaru da Universidade de Exeter.
A equipe de pesquisadores, liderada pelo professor Gero Steinberg, combinou abordagens de imagem de células vivas e genética molecular para entender por que a inibição da síntese de ergosterol resulta na morte celular no fungo patogênico de culturas Zymoseptoria tritic (Z. tritici). Este fungo causa a mancha septória nas folhas do trigo, uma doença grave em climas temperados, estimada em causar mais de 300 milhões de dólares por ano em custos só no Reino Unido devido à perda de colheita e à pulverização de fungicidas.
A equipe de Exeter observou células vivas de Z. tritici, tratou-as com azóis agrícolas e analisou a resposta celular. Eles mostraram que a ideia anteriormente aceita de que os azóis matam a célula patogênica causando a perfuração da membrana celular externa não se aplica. Em vez disso, descobriram que a redução do ergosterol induzida pelo azol aumenta a actividade das mitocôndrias celulares, a “central de força” da célula, necessária para produzir o combustível celular que impulsiona todos os processos metabólicos na célula patogénica.
Embora produzir mais “combustível” não seja prejudicial por si só, o processo leva à formação de mais subprodutos tóxicos. Esses subprodutos iniciam um programa de “suicídio” na célula do patógeno, denominado apoptose. Além disso, os níveis reduzidos de ergosterol também desencadeiam uma segunda via de “autodestruição”, que faz com que a célula coma os seus próprios núcleos e outras organelas vitais – um processo conhecido como macroautofagia. Os autores mostram que ambas as vias de morte celular sustentam a atividade letal dos azóis. Eles concluem que os azóis levam o patógeno fúngico ao “suicídio”, iniciando a autodestruição.
Os autores encontraram o mesmo mecanismo que os azóis matam células patogênicas no fungo da brusone do arroz Magnaporthe oryzae. A doença causada por este fungo mata até 30% do arroz, uma cultura alimentar essencial para mais de 3,5 mil milhões de pessoas em todo o mundo. A equipe também testou outros medicamentos antifúngicos clinicamente relevantes que visam a biossíntese do ergosterol, incluindo terbinafina, tolfonato e fluconazol. Todos iniciaram as mesmas respostas na célula patogénica, sugerindo que o suicídio celular é uma consequência geral dos inibidores da biossíntese do ergosterol.
O autor principal, Professor Gero Steinberg, que ocupa uma cátedra em Biologia Celular e é Diretor do Centro de Bioimagem da Universidade de Exeter, disse:"Nossas descobertas reescrevem o entendimento comum de como os azóis matam os patógenos fúngicos. Mostramos que os azóis desencadeiam o 'suicídio' celular programas, que resultam na autodestruição do patógeno. Esta reação celular ocorre após dois dias de tratamento, sugerindo que as células atingem um “ponto sem retorno” após algum tempo de exposição aos azóis. contra os azóis, o que explica porque é que a resistência aos azóis está a avançar nos agentes patogénicos fúngicos, o que significa que é mais provável que não consigam matar a doença nas culturas e nos seres humanos.
"Nosso trabalho esclarece a atividade de nossos agentes de controle químico mais amplamente utilizados em culturas e patógenos humanos em todo o mundo. Esperamos que nossos resultados sejam úteis para otimizar estratégias de controle que possam salvar vidas e garantir a segurança alimentar para o futuro. "
