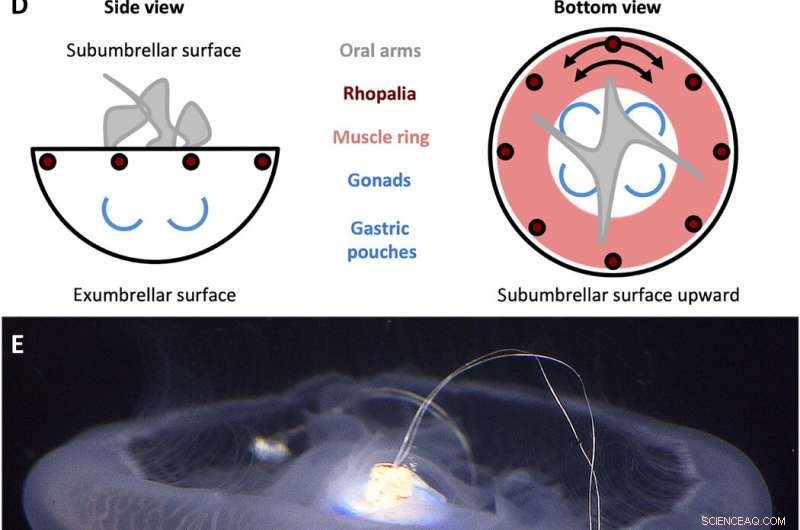
A. Projeto de controlador de natação aurita. (A) Sinal de onda quadrada gerado pelo controlador de natação com uma amplitude (A) de 3,7 V e uma largura de pulso (T) de 10 ms, definido nas frequências (f) de 0,25, 0,38, 0,50, 0,62, 0,75, 0,88, e 1,00 Hz. (B) Componentes do controlador de natação. A caixa inclui (i) uma tampa de polipropileno com um pino de madeira que se encaixa no centro do sino, e (ii) uma película de plástico para impermeabilizar a caixa, ambos compensados com pesos de aço inoxidável e cortiça para manter o dispositivo com flutuabilidade aproximadamente neutra. A microeletrônica inclui (iii) um mini-processador TinyLily, (iv) bateria de polímero de lítio, e (v) dois eletrodos de ponta de platina com LEDs para indicar visualmente a estimulação. (C) Dispositivo totalmente montado, com o processador e a bateria encaixados na caixa. (D) Esquemas simplificados da anatomia de A. aurita, destacando as superfícies subumbrelares (superior) e exumbrelares (inferior), rhopalia, anel de músculo, e orientação da fibra muscular circunferencial, braços orais, e gônadas / bolsas gástricas. (E) Controlador de natação (inativo) embutido em uma água-viva nadando livremente, sino orientado com o lado subumbrelar para cima, com o pino de madeira inserido no manúbrio e dois eletrodos embutidos no músculo e tecido mesogleal próximo à margem do sino. Créditos das fotos para (B), (C), e (E):Nicole W. Xu, Universidade de Stanford. Crédito:Science Advances, doi:10.1126 / sciadv.aaz3194
Pesquisadores em materiais robóticos visam controlar artificialmente a locomoção de animais para enfrentar os desafios existentes para a atuação, requisitos de controle e potência em robótica leve. Em um novo relatório em Avanços da Ciência , Nicole W. Xu e John O. Dabiri nos departamentos de bioengenharia, a engenharia civil e ambiental e a engenharia mecânica da Universidade de Stanford apresentaram um robô biohíbrido que usava microeletrônica a bordo para induzir a natação em águas-vivas vivas. Eles mediram a capacidade de aumentar substancialmente a propulsão, conduzindo as contrações do corpo em uma faixa de frequência ideal mais rápido do que o comportamento natural. A manobra aumentou a velocidade de natação em quase três vezes, embora com apenas um aumento de duas vezes no gasto metabólico do animal e 10 mW de entrada de energia externa para a microeletrônica. O robô biohíbrido usou de 10 a 1000 vezes menos energia externa por massa do que robôs aquáticos relatados anteriormente. A capacidade pode melhorar o escopo de desempenho de robôs biohíbridos em relação ao desempenho nativo, com aplicações potenciais como robôs biohíbridos de monitoramento oceânico.
As medusas são um organismo modelo atraente para formar veículos subaquáticos com eficiência energética devido ao seu baixo custo de transporte (COT). Os robôs biomiméticos existentes de animais nadadores que são inteiramente construídos com materiais de engenharia podem atingir velocidades comparáveis aos animais naturais, mas com ordens de magnitude menos eficientes do que águas-vivas. Robôs de água-viva bio-híbridos podem, portanto, integrar animais vivos para enfrentar os desafios existentes da robótica leve. Os pesquisadores podem usar a estrutura da água-viva para atuação e resolver os requisitos de energia, explorando comportamentos alimentares naturais, onde extraem energia química da presa in situ. A abordagem também pode permitir a recuperação de danos por meio de processos naturais de cicatrização de feridas inerentes ao animal, controlar a locomoção animal e permitir estudos adicionais da biomecânica de organismos vivos em experimentos controlados pelo usuário. Neste estudo, Xu e Dabiri usaram um sistema de microeletrônica para controlar externamente uma água-viva viva e formar um robô biohíbrido para o avanço da ciência e da engenharia da locomoção aquática.
Para ativar a água-viva como um andaime natural, a equipe usou o metabolismo basal do próprio animal para reduzir os requisitos adicionais de energia e alavancou seus músculos para a atuação enquanto confiava nas propriedades de autocura e regeneração do tecido para aumentar a tolerância a danos. A equipe formulou a hipótese de que o aumento das frequências de contração do sino das águas-vivas poderia aumentar a velocidade de natação até um limite. Portanto, eles controlavam externamente a frequência dos pulsos em animais que nadavam livremente medindo a velocidade de nado e o consumo de oxigênio para calcular o custo de transporte (COT) e testar sua hipótese de trabalho. Anteriormente, esses exames só eram possíveis por meio de modelos computacionais ou teóricos.
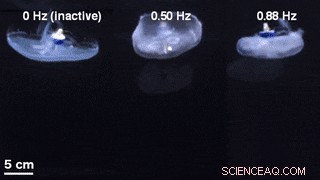
Uma comparação de geometrias de sino para natação não estimulada com um controlador de natação inativo embutido (esquerda) e natação controlada externamente a 0,50 Hz (meio) e 0,88 Hz (direita). Crédito:Science Advances, doi:10.1126 / sciadv.aaz3194
Xu et al. selecionou Aurelia aurita como organismo modelo; uma espécie achatada de água-viva contendo um sino mesogleal flexível e uma monocamada de músculos coronais e radiais que revestem a superfície subumbrelar. Para nadar, os organismos contraíram músculos para diminuir o volume da cavidade subumbrelar e ejetar água para fornecer uma força motriz ao lado de contribuições adicionais de recaptura de energia passiva e propulsão baseada na sucção. Para iniciar essas contrações musculares, a água-viva ativou qualquer um de seus marcapassos leves localizados nos órgãos sensores conhecidos como ropalia ao longo da margem do sino. Esses agrupamentos de nervos ativaram toda a rede nervosa motora para causar propagações de ondas musculares bidirecionais que se originaram dos marcapassos ativados durante a propagação natural.
Integração de design robótico em água-viva viva e validação de dispositivo
Os cientistas primeiro projetaram um portátil, controlador de natação microeletrônico autônomo para gerar uma onda de pulso quadrada e estimular as contrações musculares de 0,25 Hz a 1,00 Hz. Eles compuseram o controlador com um mini-processador TinyLily e uma célula de polímero de lítio de 10 mAh. Para confirmar visualmente o sinal elétrico, Xu et al. conectou os fios em série aos diodos emissores de luz (LEDs) TinyLily. Eles então inseriram eletrodos bilateralmente no tecido subumbrelar e mantiveram o sistema naturalmente flutuante com arruelas de aço inoxidável e cortiça. Para validar que o controlador de natação pode controlar externamente as contrações do sino da água-viva, os cientistas desenvolveram um método para rastrear o movimento da margem do sino. Por esta, eles completaram três conjuntos de experimentos, (1) para observar as contrações endógenas do organismo na ausência de quaisquer distúrbios, (2) para observar se a incorporação mecânica de eletrodos inativos afetou o comportamento natural do animal e (3) para testar os protocolos de estimulação para confirmar as contrações dirigidas externamente.
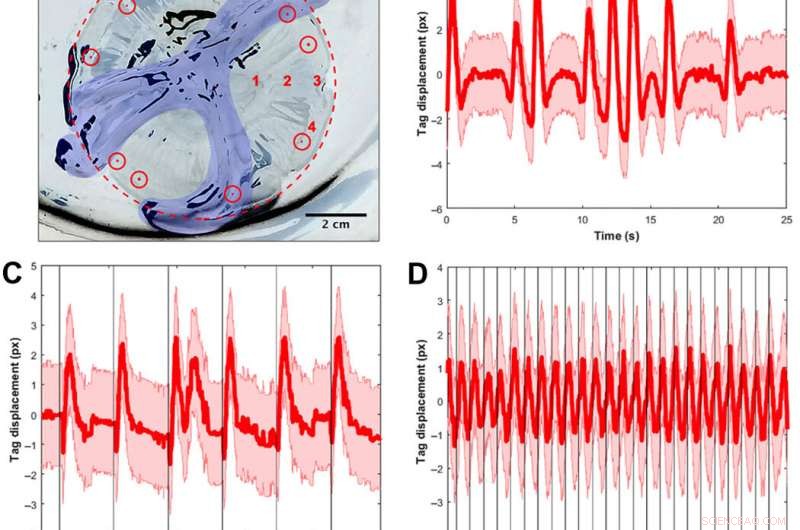
Validação de sinal usando tags visuais e espectros de frequência para rastrear as contrações musculares. (A) A. aurita medusae (n =10, 8,0 a 10,0 cm de diâmetro) foram colocados na superfície subumbrelar em uma placa sem água do mar para experimentos de estimulação muscular restrita (eletrodo não mostrado). A imagem é invertida para que o sino e a placa fiquem brancos, e as áreas pretas são reflexos da luz do tecido animal e da placa. Para maior clareza, a margem do sino é delineada em um círculo pontilhado vermelho, e os braços orais são coloridos em azul. Etiquetas de elastômero de implante visíveis (mostradas como pontos vermelhos coloridos dentro de círculos vermelhos) foram injetadas em torno da margem, e uma marca foi rastreada por vídeo para calcular o deslocamento do tecido como um substituto para as contrações musculares. Os testes espaciais para determinar se a localização do eletrodo afetou os espectros foram realizados em quatro locais, rotulados em números vermelhos:(1) adjacente às bolsas gástricas, (2) a meio caminho entre as bolsas gástricas e a margem, (3) na rhopalia, e (4) na margem longe da ropalia. Todos os outros testes foram conduzidos no local 2. (B) Exemplo de deslocamento da etiqueta em função do tempo para um animal sem qualquer estímulo externo. A linha vermelha indica o deslocamento do centróide, com o erro calculado assumindo uma incerteza de meio pixel em encontrar o centroide da tag em cada imagem, mais de 25 s. Observe a variação temporal das contrações musculares, incluindo períodos de pulsos regulares e pulsos rápidos sucessivos. (C) Exemplo de deslocamento da etiqueta para um animal com um estímulo externo de 0,25 Hz, com cada estímulo visualizado como uma linha preta vertical. Embora as contrações sigam regularmente estímulos externos, pulsos naturais de animais também ocorrem em baixas frequências. Observação, por exemplo, o pulso duplo após um estímulo (t ≈ 12 s). (D) Exemplo de deslocamento da etiqueta para um animal com um estímulo externo de 1,00 Hz, com cada estímulo visualizado como uma linha preta vertical. A mesma janela de tempo (25 s) é mostrada para uma comparação justa com os dois gráficos anteriores. As contrações seguem regularmente os estímulos externos. (E) espectro de amplitude unilateral (SSASs) calculado para água-viva sem qualquer estímulo externo (n =12 para 10 animais, ou seja, 2 medusas tinham dois clipes replicados cada). A linha vermelha indica a média de SSAS normalizado para cada réplica, com o SD em rosa. O pico do SSAS médio está em 0,16 Hz. A largura total na metade do máximo (FWHM) é 0,24 Hz. (F) Resposta da água-viva a um eletrodo inativo embutido (n =14 para 10 animais, ou seja, 4 medusas tinham dois clipes replicados cada). O pico do SSAS médio é de 0,18 Hz. O FWHM é 0,16 Hz. Usando um teste t de duas amostras das frequências de pico para ambos os grupos, a diferença entre as duas amostras foi estatisticamente insignificante (P =0,68). (G) SSAS de amostra para um estímulo elétrico a 1,00 Hz (n =10 água-viva para um sinal de entrada de 4,2 V e 4,0 ms). A frequência de pico ocorre em 1,02 Hz, dentro da janela de 0,02 usada para calcular o SSAS. Observe que o espectro tem um pico mais nítido na frequência de interesse (FWHM de 0,04 Hz), em oposição a um FWHM mais amplo em (B) e (C), os casos sem qualquer estímulo externo. (H) Mapa de contorno da resposta de frequência das contrações musculares a estímulos elétricos externos. Cada linha vertical de dados (centralizada em linhas brancas em 0,25, 0,50, 0,75, 1,00, 1,20, 1,50, e 2,00 Hz) representa o PSD em uma frequência de entrada elétrica, com o número de medusas testadas mostrado acima. As cores correspondem à amplitude do PSD, em que os valores mais altos são mostrados em amarelo e os valores mais baixos em azul. A linha vermelha sólida representa uma resposta de entrada-saída um para um, e a linha vermelha tracejada representa o limite fisiológico relatado de acordo com o período refratário mínimo absoluto do músculo A. aurita (32). Os ensaios responsivos são definidos se as frequências de pico no PSD estão dentro de uma janela de 0,06 Hz da curva vermelha sólida. (I) Mapas de contorno das tentativas sem resposta. Frequências mais altas de até 90,00 Hz também foram testadas com PSDs sem resposta semelhantes. Crédito da foto para (A):Nicole W. Xu, Universidade de Stanford. Crédito:Science Advances, doi:10.1126 / sciadv.aaz3194
Eles descobriram que o comportamento animal natural (ou contração endógena) era irregular, com alta variabilidade da taxa de pulso - incluindo uma frequência de pico média de 0,16 Hz. Um eletrodo inativo não alterou significativamente os espectros de frequência, enquanto as contrações dirigidas externamente mostraram um limite fisiológico das contrações musculares da água-viva entre 1,4 Hz a 1,5 Hz. A equipe conduziu testes de natação com o sistema implantado em um tanque de água salgada e normalizou as velocidades de natação medidas para levar em conta a variação no tamanho do animal. Eles escalaram a velocidade de natação normalizada pela média da velocidade normalizada na ausência de estimulação (ou seja, 0 Hz) para determinar o fator de intensificação. O fator de aprimoramento máximo foi de até 2,8 vezes a velocidade natural de natação dos animais, ou seja, a velocidade de natação aumentou em até 2,8 vezes usando microeletrônica a bordo.
Consumo de energia do dispositivo altamente eficiente
A água-viva controlada artificialmente requer energia externa do sistema microeletrônico e energia interna do próprio metabolismo dos animais. Quando conduzido em frequências crescentes, o sistema microeletrônico da água-viva robótica biohíbrida consumiu mais Watts por kg. Contudo, em comparação com os robôs existentes, este robô biohíbrido usou até 1000 vezes menos energia externa. Xu et al. comparou este protótipo com o raio medusoide e robótico feito de cardiomiócitos de rato semeados em suportes de silício, e com robôs puramente mecânicos, bem como veículos subaquáticos autônomos (AUVs). Além dos benefícios econômicos de baixo consumo de energia externa por massa do robô biohíbrido, o sistema microeletrônico custa menos de US $ 20 em componentes disponíveis comercialmente. A eletrolocalização também foi inespecífica e os animais se recuperaram imediatamente após os experimentos.
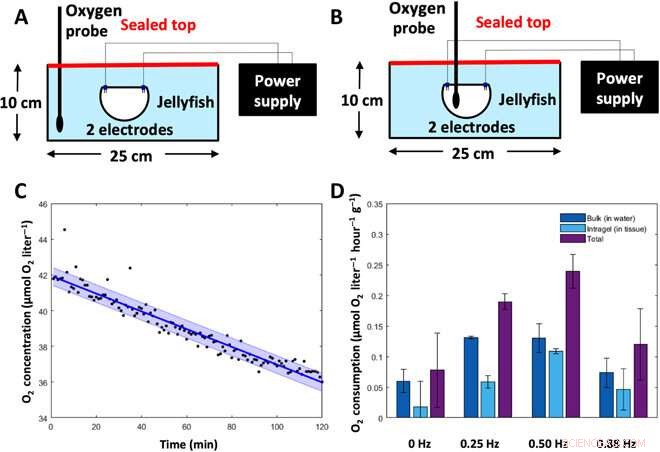
Metabolic rate experiments. To determine the metabolic rate of jellyfish, oxygen concentrations were measured in animal tissue and the surrounding water and then converted into energy expenditure. (A) Experimental setup to measure bulk dissolved oxygen concentrations (in the water). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Oxygen levels in the water were measured using a MicroOptode oxygen probe. (B) Experimental setup to measure intragel oxygen concentrations (in the tissue). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Intragel oxygen levels were measured using a MicroOptode oxygen probe embedded into the tissue. (C) Representative plot of oxygen concentrations over time, measured from the MicroOptode. This example shows measurements of bulk oxygen levels in the water surrounding an animal with a swim controller–driven frequency of 1.00 Hz. Individual data points are shown in black, the best-fit line is shown in dark blue, and the SD is shown in the light blue shaded region. (D) Oxygen consumption rates of the surrounding water (dark blue), within animal tissue (light blue), and total (sum of the water and tissue measurements, purple) were calculated over a 6- to 8-hour period (n =7 animals).Credit:Science Advances, doi:10.1126/sciadv.aaz3194
The new capability of external control allowed Xu et al. to address the relationship between swimming frequency and metabolic rate. Oxygen consumption rates followed a similar pattern to enhanced swimming speeds, and the scientists calculated the equivalent cost of transport using both experimental metabolic rates and experimental swimming speeds. The COT increased at mid-range frequencies and decreased at high external stimulation frequencies. The results showed that enhanced jellyfish swimming did not cause undue cost to the metabolism or health of the animal.
The main robotic limit of the study was the power requirement of the microelectronic system relative to animal versus microelectronic power needs. Further improvement to microelectronics can decrease the energetic costs and extended studies can also strive to minimize endogenous animal contractions without harming the organism to improve controllability of live-animal-based biohybrid robots. The artificial control of jellyfish can expand ocean monitoring techniques with improved controllability by incorporating microelectronic sensors to leverage the existing tagging technology.
© 2020 Science X Network