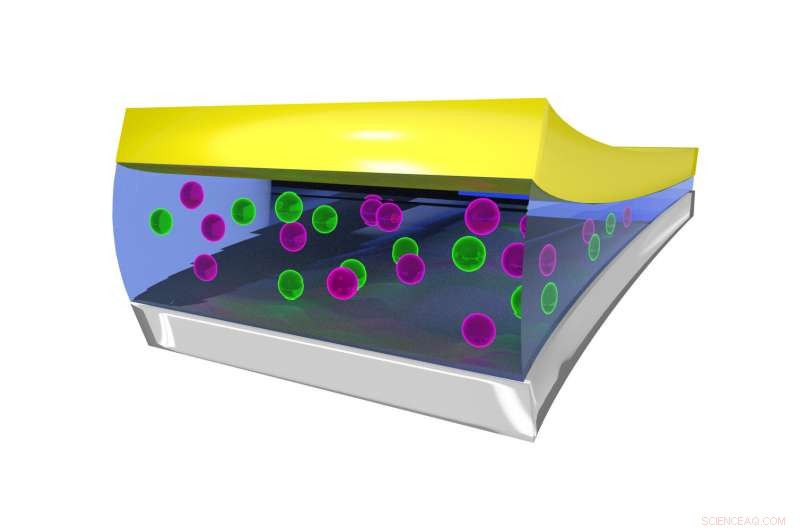
Imagem estática mostrando o ambiente de coordenação do íon F no eletrólito líquido, estabilizado por moléculas de BTFE. Crédito:Dr. Brett Savoie - Caltech / Perdue
Imagine não ter que carregar seu telefone ou laptop por semanas. Esse é o sonho dos pesquisadores que buscam baterias alternativas que vão além das atuais versões de íon-lítio populares hoje. Agora, em um novo estudo publicado no jornal Ciência , químicos em várias instituições, incluindo Caltech e o Laboratório de Propulsão a Jato, que é gerenciado pela Caltech para a NASA, bem como o Honda Research Institute e o Lawrence Berkeley National Laboratory, descobriram uma nova maneira de fazer baterias recarregáveis à base de flúor, a forma carregada negativamente, ou ânion, do elemento flúor.
"As baterias de flúor podem ter uma densidade de energia maior, o que significa que eles podem durar mais - até oito vezes mais do que as baterias em uso hoje, "diz o co-autor do estudo, Robert Grubbs, Victor e Elizabeth Atkins da Caltech, Professores de Química e ganhadora do Prêmio Nobel de Química em 2005. "Mas pode ser difícil trabalhar com flúor, em particular porque é muito corrosivo e reativo. "
Na década de 1970, pesquisadores tentaram criar baterias recarregáveis de flúor usando componentes sólidos, mas as baterias de estado sólido funcionam apenas em altas temperaturas, tornando-os impraticáveis para o uso diário. No novo estudo, os autores relatam finalmente descobrir como fazer as baterias de flúor funcionarem usando componentes líquidos - e as baterias líquidas funcionam facilmente em temperatura ambiente.
"Ainda estamos nos estágios iniciais de desenvolvimento, mas esta é a primeira bateria recarregável de flúor que funciona em temperatura ambiente, "diz Simon Jones, um químico do JPL e autor correspondente do novo estudo.
As baterias conduzem correntes elétricas transportando átomos carregados - ou íons - entre um eletrodo positivo e um negativo. Este processo de transporte ocorre mais facilmente à temperatura ambiente quando há líquidos envolvidos. No caso das baterias de íon-lítio, o lítio é transportado entre os eletrodos com a ajuda de uma solução líquida, ou eletrólito.
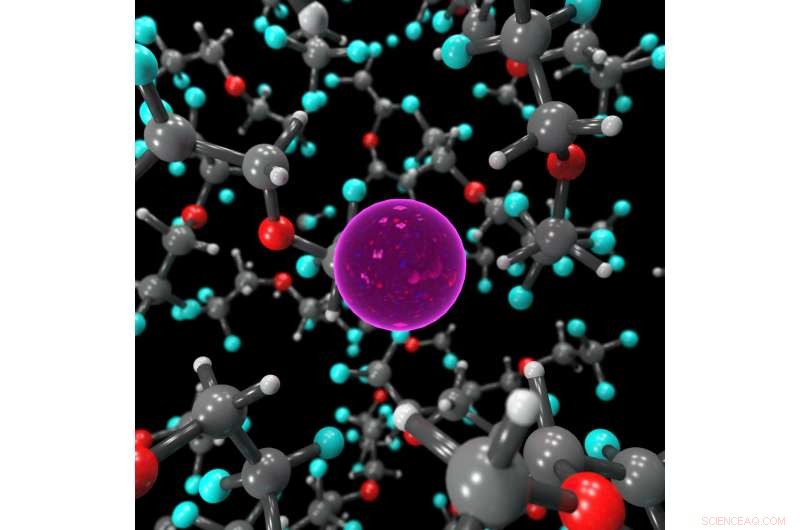
Imagem estática mostrando o ambiente de coordenação do íon F no eletrólito líquido, estabilizado por moléculas de BTFE. Crédito:Dr. Brett Savoie - Caltech / Perdue
"Recarregar uma bateria é como empurrar uma bola colina acima e depois deixá-la rolar de volta, de novo e de novo, "diz o co-autor Thomas Miller, professor de química na Caltech. "Você vai e volta entre armazenar a energia e usá-la."
Embora os íons de lítio sejam positivos (chamados cátions), os íons de flúor usados no novo estudo carregam uma carga negativa (e são chamados de ânions). Existem desafios e vantagens em trabalhar com ânions em baterias.
"Para uma bateria que dura mais, você precisa mover um número maior de cargas. Mover cátions metálicos com carga múltipla é difícil, mas um resultado semelhante pode ser alcançado movendo vários ânions carregados individualmente, que viajam com relativa facilidade, "diz Jones, quem faz pesquisas no JPL sobre as fontes de energia necessárias para espaçonaves. “Os desafios deste esquema são fazer com que o sistema funcione em tensões utilizáveis. Neste novo estudo, demonstramos que os ânions são realmente dignos de atenção na ciência das baterias, uma vez que mostramos que o flúor pode funcionar em tensões suficientemente altas. "
A chave para fazer as baterias de flúor funcionarem em um estado líquido em vez de sólido acabou sendo um eletrólito líquido chamado bis (2, 2, 2-trifluoroetil) éter, ou BTFE. Esse solvente é o que ajuda a manter o íon fluoreto estável para que ele possa transportar elétrons de um lado para outro na bateria. Jones disse que seu estagiário na época, Victoria Davis, que agora estuda na Universidade da Carolina do Norte, Chapel Hill, foi o primeiro a pensar em experimentar o BTFE. Embora Jones não tivesse muita esperança de sucesso, a equipe decidiu tentar mesmo assim e ficou surpresa por ter funcionado tão bem.
Nesse ponto, Jones pediu ajuda a Miller para entender por que a solução funcionava. Miller e seu grupo fizeram simulações de computador da reação e descobriram quais aspectos do BTFE estavam estabilizando o flúor. De lá, a equipe conseguiu ajustar a solução BTFE, modificando-o com aditivos para melhorar seu desempenho e estabilidade.
"Estamos descobrindo uma nova maneira de fabricar baterias de longa duração, "diz Jones." O flúor está voltando nas baterias. "