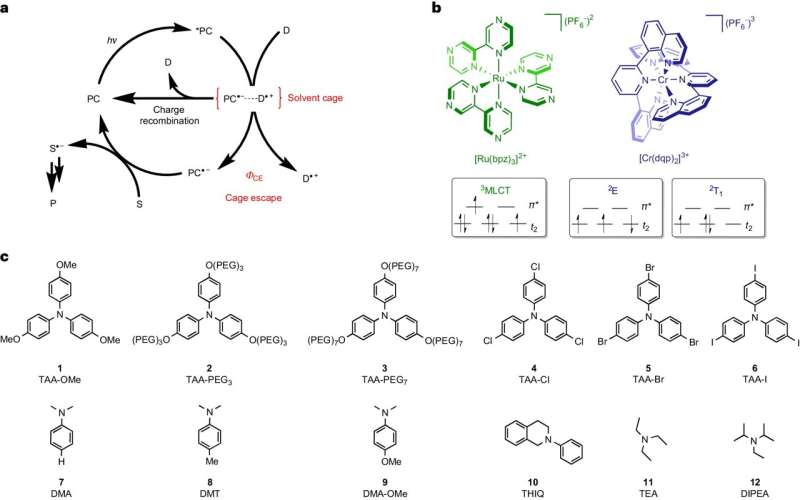
 Transferência de elétrons fotoinduzida entre complexos metálicos e aminas terciárias. Crédito:Química da Natureza (2024). DOI:10.1038/s41557-024-01482-4
Transferência de elétrons fotoinduzida entre complexos metálicos e aminas terciárias. Crédito:Química da Natureza (2024). DOI:10.1038/s41557-024-01482-4 Qualquer pessoa que queira produzir medicamentos, plásticos ou fertilizantes utilizando métodos convencionais precisa de calor para reações químicas – mas o mesmo não acontece com a fotoquímica, onde a luz fornece a energia. O processo para alcançar o produto desejado também muitas vezes requer menos etapas intermediárias.
Pesquisadores da Universidade de Basileia estão agora dando um passo adiante e demonstrando como a eficiência energética das reações fotoquímicas pode ser aumentada em 10 vezes. Aplicações mais sustentáveis e económicas estão agora tentadoramente próximas.
As reações químicas industriais geralmente ocorrem em vários estágios em vários produtos intermediários. A fotoquímica permite atalhos, o que significa que são necessárias menos etapas intermediárias. A fotoquímica também permite trabalhar com substâncias menos perigosas do que na química convencional, pois a luz produz uma reação em substâncias que não reagem bem ao calor. No entanto, até este ponto não houve muitas aplicações industriais para a fotoquímica, em parte porque o fornecimento de energia com luz é muitas vezes ineficiente ou cria subprodutos indesejados.
O grupo de pesquisa liderado pelo professor Oliver Wenger da Universidade de Basileia descreve agora um princípio fundamental que tem um impacto inesperadamente forte na eficiência energética da fotoquímica e pode aumentar a velocidade das reações fotoquímicas. Seus resultados são publicados em Nature Chemistry .
No caso deste tipo de reação, as moléculas iniciais estão em solução líquida. Se receberem energia na forma de luz, podem trocar elétrons entre si e formar radicais. Essas moléculas extremamente reativas ocorrem sempre aos pares e permanecem rodeadas por solvente, que envolve os pares de radicais como uma espécie de gaiola.
Para que os radicais possam continuar a reagir aos produtos alvo desejados, eles precisam “sair” desta gaiola e encontrar um parceiro de reação fora dela. A equipe que cerca Wenger e seu pós-doutorado, Dr. Cui Wang, identificou esse processo de ruptura como um passo decisivo que limita a eficiência energética e a velocidade das reações fotoquímicas.
Os radicais se libertam
Enquanto os radicais permanecerem aos pares na gaiola do solvente, eles podem reagir espontaneamente uns com os outros de volta aos materiais de partida. Essa reação reversa desperdiça energia porque utiliza apenas a luz já absorvida para voltar ao ponto inicial.
A equipe do Basileia conseguiu desacelerar essa reação reversa e, portanto, dar mais tempo aos radicais para saírem da jaula. Quanto mais longa se tornava a reacção inversa indesejada, mais radicais eram capazes de se libertar e mais eficientes em termos energéticos e mais rápidos eram desenvolvidos os produtos-alvo desejados.
Wang, que hoje ocupa o cargo de professora assistente na Universidade de Osnabrück, usou dois corantes específicos em seu estudo, ambos absorvendo luz e armazenando sua energia por um curto período antes de usá-la para formar pares de radicais. No entanto, um dos dois corantes examinados foi capaz de armazenar significativamente mais energia do que o outro e transferi-la para os radicais.
Devido à energia adicional, os radicais conseguiram sair da gaiola do solvente até dez vezes mais eficientemente. Consequentemente, os produtos alvo são produzidos com eficiência energética até dez vezes maior. “Esta ligação direta entre os radicais que saem da gaiola do solvente e a formação eficiente dos produtos alvo é surpreendentemente clara”, afirmou Wang.
A principal descoberta é que certos corantes podem liberar mais radicais do que outros de acordo com a quantidade de luz absorvida. “A escolha do corante pode ser utilizada para aumentar a eficiência energética das reações fotoquímicas”, disse Wenger. Por sua vez, afirma que a eficiência energética também é um critério decisivo para o uso industrial da fotoquímica.
