Como uma determinada proteína regula até dois terços das emissões de metano do mundo
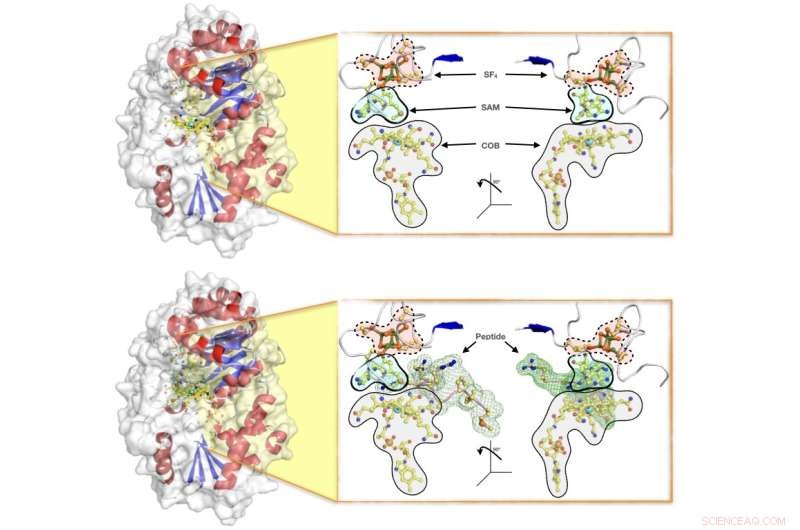
Ilustrações de superfície da enzima Mmp10, mostrando (em cima) a proteína com o conjunto completo de cofatores necessários para que a reação enzimática ocorra (a saber:o cluster SF4, o SAM e a cobalamina COB) e (abaixo) a enzima em ação enquanto acomoda o peptídeo para transferência de metila. A equipe de pesquisa elucidou os detalhes cristalográficos da reação e propôs um mecanismo pelo qual a proteína ativa uma proteína parceira que se destaca como um dos principais contribuintes da produção natural de metano em archaea, que representa cerca de dois terços da produção global de metano. Crédito:Leo Chavas
Embora o metano seja responsável por cerca de 16% da abundância na atmosfera de gases de efeito estufa – que também incluem dióxido de carbono, óxido nitroso, vapor de água – é mais de 25 vezes melhor do que o dióxido de carbono na retenção de calor. Acredita-se que dois terços da liberação global de metano seja através da emissão natural durante a atividade anaeróbica de microrganismos unicelulares primitivos chamados archaea. Compreender o mecanismo preciso pelo qual as archaea produzem metano pode levar a uma tecnologia que reduza a produção de metano por archaea e ajude na luta contra o aquecimento global.
Archaea são distintas das bactérias principalmente por causa de seu habitat e fontes de energia. As chamadas archaea metanogênicas emitem metano como subproduto da geração de energia necessária para sua sobrevivência. A biomolécula responsável pela formação do metano é a chamada proteína Metil-Coenzima M Redutase (ou MCR) que induz a conversão química. Para que o MCR catalise essa reação reversível, ele precisa ser ativado por uma proteína parceira que pertence à superfamília de enzimas S-Adenosil-L-Metionina (ou SAM) do radical dependente de B12.
A superfamília de enzimas SAM radicais contém mais de 200.000 proteínas sequenciadas de forma independente. Tem sido associado a uma infinidade de processos naturais, incluindo a biossíntese de antibióticos e clorofila. Uma dessas enzimas-chave (Mmp10) é responsável pela ativação da proteína MCR e, portanto, está envolvida na regulação de sua formação de metano. A onipresença das enzimas SAM em toda a biosfera reflete sua importância na catalisação de reações que são fundamentais para todos os tipos de vida. No entanto, os mecanismos que equilibram suas atividades biológicas permanecem pouco compreendidos.
Para decifrar as atividades da enzima Mmp10 SAM, o Dr. Olivier Berteau, do Instituto Micalis, Université Paris-Saclay, reuniu uma equipe de especialistas científicos com diversas áreas de especialização complementares, incluindo outros pesquisadores daquela universidade, Aix Marseille University e Synchrotron SOLEIL na França, bem como a Universidade de Nagoya no Japão. Os resultados da investigação foram publicados online na revista
Nature em 2 de fevereiro de 2022.
A chave para a atividade das enzimas SAM radicais dependentes de B12 é um mecanismo simples, porém poderoso, para desencadear a reação catalítica. A dificuldade em conseguir que a enzima acomode simultaneamente todos os atores envolvidos na reação fez com que houvesse pouca informação estrutural disponível que pudesse ajudar a explicar como a reação funciona.
Para remediar isso, a equipe de pesquisa combinou resultados cristalográficos com dados bioquímicos e biofísicos para explicar como as proteínas SAM radicais dependentes de B12 regulam sua atividade, até detalhes de nível atômico. O mecanismo enzimático Mmp10 foi fotografado com todos os atores da reação presentes.
Os resultados desta pesquisa têm implicações para o desenvolvimento de biotecnologias que controlariam os principais eventos enzimáticos, particularmente aqueles implicados na emissão de metano, auxiliando no combate ao aquecimento global.
O coautor Professor Leo Chavas, da Universidade de Nagoya, está animado com os resultados desta investigação de longo prazo. "Um total de 137 proteínas foram rastreadas em uma instalação síncrotron líder na França para obter um vislumbre desses eventos raros, que são tão difíceis de detectar. Esta pesquisa também abre as portas para desenvolvimentos de biotecnologia."
