Usando técnicas de eletroquímica para projetar catalisadores para combustíveis sustentáveis
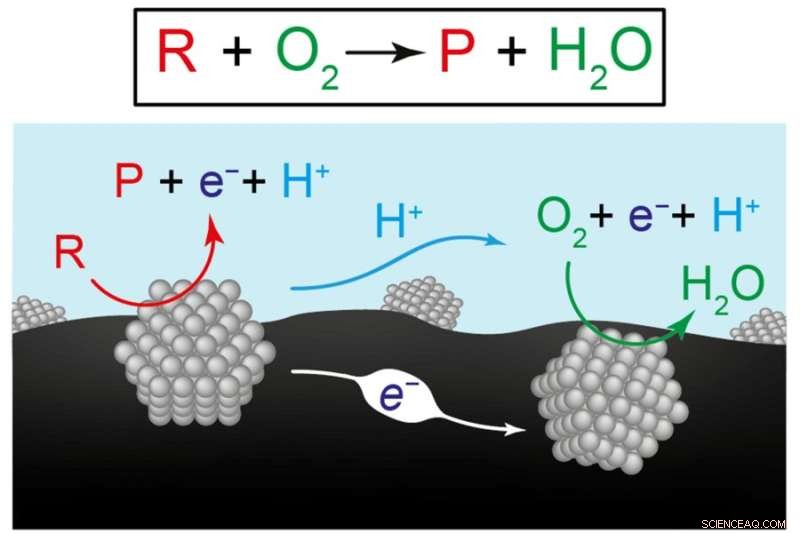
Esta figura apresenta duas visões das reações químicas para a produção de combustíveis e produtos químicos renováveis. A equação de cima representa a conversão do reagente (R) mais oxigênio (O2) em um produto (P) mais água (H2O). O diagrama abaixo ilustra a hipótese dos pesquisadores de que a reação geral é o resultado de duas semi-reações coordenadas que ocorrem em materiais catalíticos separados, aqui representados por estruturas cinzas. No catalisador da esquerda, o reagente se transforma em produto, enviando elétrons (e-) para o material de suporte de carbono (preto) e prótons (H+) para a água (azul). No catalisador da direita, elétrons e prótons são consumidos à medida que conduzem a reação do oxigênio à água. Crédito:Imagem cortesia dos pesquisadores.
Um desafio na descarbonização do sistema energético é saber lidar com novos tipos de combustíveis. Combustíveis tradicionais, como gás natural e petróleo, podem ser combinados com outros materiais e depois aquecidos a altas temperaturas para que reagem quimicamente para produzir outros combustíveis ou substâncias úteis, ou mesmo energia para realizar trabalho. Mas novos materiais, como biocombustíveis, não podem suportar tanto calor sem se decompor.
Um ingrediente chave em tais reações químicas é um catalisador sólido especialmente projetado que é adicionado para estimular a reação, mas não é consumido no processo. Com materiais tradicionais, o catalisador sólido normalmente interage com um gás; mas com combustíveis derivados de biomassa, por exemplo, o catalisador deve funcionar com um líquido – um desafio especial para quem projeta catalisadores.
Por quase uma década, Yogesh Surendranath, professor associado de química do MIT, tem se concentrado em reações químicas entre catalisadores sólidos e líquidos, mas em uma situação diferente:em vez de usar calor para gerar reações, ele e sua equipe recebem eletricidade de um bateria ou uma fonte renovável, como eólica ou solar, para dar mais energia às moléculas quimicamente inativas para que elas reajam. E a chave para sua pesquisa é projetar e fabricar catalisadores sólidos que funcionam bem para reações envolvendo líquidos.
Reconhecendo a necessidade de usar biomassa para desenvolver combustíveis líquidos sustentáveis, Surendranath se perguntou se ele e sua equipe poderiam usar os princípios que aprenderam sobre o projeto de catalisadores para conduzir reações líquido-sólido com eletricidade e aplicá-los a reações que ocorrem em interfaces líquido-sólido sem qualquer entrada de eletricidade.
Para sua surpresa, eles descobriram que seu conhecimento é diretamente relevante. Por quê? "O que descobrimos - surpreendentemente - é que mesmo quando você não conecta fios ao seu catalisador, existem minúsculos 'fios' internos que fazem a reação", diz Surendranath. "Assim, as reações que as pessoas geralmente pensam que operam sem qualquer fluxo de corrente, na verdade envolvem elétrons indo de um lugar para outro." E isso significa que Surendranath e sua equipe podem trazer as poderosas técnicas da eletroquímica para lidar com o problema de projetar catalisadores para combustíveis sustentáveis.
Uma nova hipótese Seu trabalho se concentrou em uma classe de reações químicas importantes na transição energética que envolvem a adição de oxigênio a pequenas moléculas orgânicas (contendo carbono), como etanol, metanol e ácido fórmico. A suposição convencional é que o reagente e o oxigênio reagem quimicamente para formar o produto mais água. E um catalisador sólido – geralmente uma combinação de metais – está presente para fornecer locais nos quais o reagente e o oxigênio podem interagir.
Mas Surendranath propôs uma visão diferente do que está acontecendo. Na configuração usual, dois catalisadores, cada um composto por muitas nanopartículas, são montados em um substrato de carbono condutor e submersos em água. Nesse arranjo, elétrons carregados negativamente podem fluir facilmente através do carbono, enquanto prótons carregados positivamente podem fluir facilmente através da água.
A hipótese de Surendranath era que a conversão de reagente em produto progride por meio de duas "semi-reações" separadas nos dois catalisadores. Em um catalisador, o reagente se transforma em produto, no processo enviando elétrons para o substrato de carbono e prótons para a água. Esses elétrons e prótons são captados pelo outro catalisador, onde conduzem a conversão de oxigênio em água. Assim, em vez de uma única reação, duas semi-reações separadas, mas coordenadas juntas, atingem a conversão líquida de reagente em produto.
Como resultado, a reação geral não envolve nenhuma produção ou consumo líquido de elétrons. É uma reação "térmica" padrão resultante da energia nas moléculas e talvez algum calor adicionado. A abordagem convencional para projetar um catalisador para tal reação se concentraria no aumento da taxa de conversão desse reagente em produto. E o melhor catalisador para esse tipo de reação pode ser, digamos, ouro ou paládio ou algum outro metal precioso caro.
No entanto, se essa reação realmente envolve duas semi-reações, como Surendranath propôs, há um fluxo de carga elétrica (os elétrons e prótons) entre elas. Assim, Surendranath e outros na área poderiam, em vez disso, usar técnicas de eletroquímica para projetar não um único catalisador para a reação geral, mas sim dois catalisadores separados – um para acelerar uma meia reação e outro para acelerar a outra meia reação. "Isso significa que não precisamos projetar um catalisador para fazer todo o trabalho pesado de acelerar toda a reação", diz Surendranath. “Podemos ser capazes de emparelhar dois catalisadores de baixo custo e abundantes em terra, cada um dos quais faz metade da reação bem, e juntos eles realizam a transformação geral de forma rápida e eficiente”.
Mas há mais uma consideração:os elétrons podem fluir através de todo o composto do catalisador, que engloba a(s) partícula(s) do catalisador e o substrato de carbono. Para que a conversão química aconteça o mais rápido possível, a taxa na qual os elétrons são colocados no composto catalisador deve corresponder exatamente à taxa na qual eles são retirados. Concentrando-se apenas nos elétrons, se a conversão de reação em produto no primeiro catalisador envia o mesmo número de elétrons por segundo para o "banho de elétrons" no composto de catalisador que a conversão de oxigênio em água no segundo catalisador leva fora, as duas semi-reações serão equilibradas, e o fluxo de elétrons - e a velocidade da reação combinada - será rápido. O truque é encontrar bons catalisadores para cada uma das semi-reações que sejam perfeitamente compatíveis em termos de entrada e saída de elétrons.
"Um bom catalisador ou par de catalisadores pode manter um potencial elétrico - essencialmente uma voltagem - em que ambas as semi-reações são rápidas e equilibradas", diz Jaeyune Ryu Ph.D. '21, ex-membro do laboratório Surendranath e principal autor do estudo; Ryu é agora um pós-doc na Universidade de Harvard. "As taxas das reações são iguais, e a voltagem no composto do catalisador não mudará durante a reação térmica geral."
Desenho em eletroquímica Com base em seu novo entendimento, Surendranath, Ryu e seus colegas recorreram a técnicas de eletroquímica para identificar um bom catalisador para cada semi-reação que também funcionaria bem em conjunto. Sua estrutura analítica para orientar o desenvolvimento de catalisadores para sistemas que combinam duas semi-reações é baseada em uma teoria que tem sido usada para entender a corrosão por quase 100 anos, mas raramente tem sido aplicada para entender ou projetar catalisadores para reações envolvendo pequenas moléculas importantes para a corrosão. transição energética.
A chave para seu trabalho é um potenciostato, um tipo de voltímetro que pode medir passivamente a tensão de um sistema ou alterar ativamente a tensão para causar uma reação. Em seus experimentos, Surendranath e sua equipe usam o potenciostato para medir a voltagem do catalisador em tempo real, monitorando como ele muda de milissegundo a milissegundo. They then correlate those voltage measurements with simultaneous but separate measurements of the overall rate of catalysis to understand the reaction pathway.
For their study of the conversion of small, energy-related molecules, they first tested a series of catalysts to find good ones for each half-reaction—one to convert the reactant to product, producing electrons and protons, and another to convert the oxygen to water, consuming electrons and protons. In each case, a promising candidate would yield a rapid reaction—that is, a fast flow of electrons and protons out or in.
To help identify an effective catalyst for performing the first half-reaction, the researchers used their potentiostat to input carefully controlled voltages and measured the resulting current that flowed through the catalyst. A good catalyst will generate lots of current for little applied voltage; a poor catalyst will require high applied voltage to get the same amount of current. The team then followed the same procedure to identify a good catalyst for the second half-reaction.
To expedite the overall reaction, the researchers needed to find two catalysts that matched well—where the amount of current at a given applied voltage was high for each of them, ensuring that as one produced a rapid flow of electrons and protons, the other one consumed them at the same rate.
To test promising pairs, the researchers used the potentiostat to measure the voltage of the catalyst composite during net catalysis—not changing the voltage as before, but now just measuring it from tiny samples. In each test, the voltage will naturally settle at a certain level, and the goal is for that to happen when the rate of both reactions is high.
Validating their hypothesis and looking ahead By testing the two half-reactions, the researchers could measure how the reaction rate for each one varied with changes in the applied voltage. From those measurements, they could predict the voltage at which the full reaction would proceed fastest. Measurements of the full reaction matched their predictions, supporting their hypothesis.
The team's novel approach of using electrochemistry techniques to examine reactions thought to be strictly thermal in nature provides new insights into the detailed steps by which those reactions occur and therefore into how to design catalysts to speed them up. "We can now use a divide-and-conquer strategy," says Ryu. "We know that the net thermal reaction in our study happens through two 'hidden' but coupled half-reactions, so we can aim to optimize one half-reaction at a time"—possibly using low-cost catalyst materials for one or both.
Adds Surendranath, "One of the things that we're excited about in this study is that the result is not final in and of itself. It has really seeded a brand-new thrust area in our research program, including new ways to design catalysts for the production and transformation of renewable fuels and chemicals."
+ Explorar mais Cheap, eco-friendly catalyst opens new possibilities for organic molecules built from pyruvate
Esta história foi republicada como cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisa, inovação e ensino do MIT.
