Crédito:RUDN University
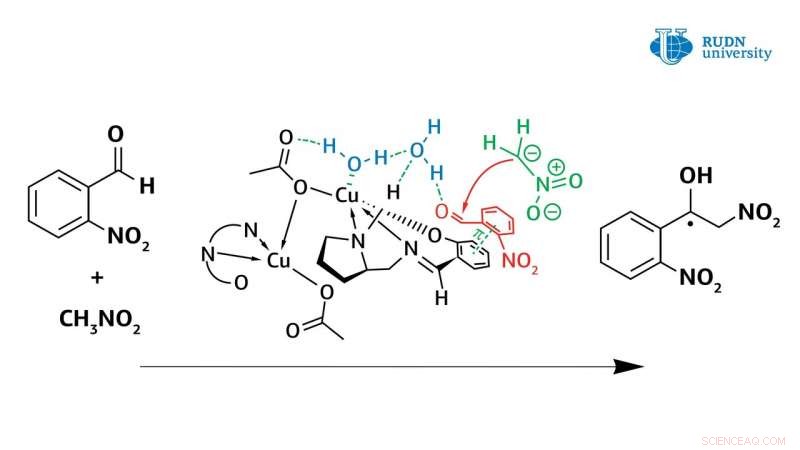
Um químico da Universidade RUDN revisou o mecanismo da reação de Henry catalisada por complexos de cobre (II). Assim, usando novos complexos de cobre (II) obtidos no mesmo laboratório, ele mostrou que a água desempenha um papel crucial na reação assimétrica de Henry, participando diretamente do ciclo catalítico da reação. Anteriormente, este fator nunca foi levado em consideração, e os cientistas pensaram que o complexo de cobre (II) funciona como um ácido de Lewis clássico.
Na verdade, o complexo de cobre em coordenação com a molécula de água o ativa, transformando-o em ácido de Bronsted, e assim, a água ativa o aldeído original. Os dados obtidos com o experimento permitem aos pesquisadores entender o mecanismo da reação de Henry e ajudarão na criação das classes de substâncias mais importantes para a indústria farmacêutica:α-nitrocetonas, cetonas, nitroalcenos e β-aminoálcoois. Os resultados são publicados na revista americana internacional Química Inorgânica .
A reação assimétrica de Henry, permitindo a síntese de moléculas orgânicas valiosas, foi conduzido pela primeira vez pelo químico japonês Masakatsu Shibasaki em 1992. Ele foi capaz de conduzir uma reação com alta enantiosseletividade usando catalisadores baseados em complexos de cobre. Contudo, antes deste trabalho, ainda havia dúvidas sobre o mecanismo dessa reação. Químico Vladimir Larionov, um funcionário do Departamento de Química Inorgânica da RUDN University, em experimentos usando novos complexos de cobre (II), mostraram que a molécula de água desempenha um papel crucial na reação de Henry e está diretamente envolvida no ciclo catalítico. Anteriormente, os cientistas não prestaram muita atenção a isso, mas apenas afirmou o fato de que a taxa de reação aumenta em várias ordens com a participação da água.
Esses complexos podem ser usados para produzir precursores de drogas, como (S) -propranolol (β-bloqueador), (R) -norepinefrina e (R) -salbutamol (agonistas do receptor β), amprenavir-Vertex 478 (inibidor da protease do HIV) e L-acosamina (classe de antibióticos antraciclínicos).
Era sabido por estudos anteriores que a reação assimétrica de Henry é melhor realizada em solventes aquosos e alcoólicos. Portanto, os autores do estudo testaram a reação em solventes (metanol, aldeído-nitrometano-água) com dois sistemas catalíticos - complexos de cobalto (III) e cobre (II). No caso do complexo de cobalto, o íon metálico não participou da reação, e o íon cobre poderia coordenar a molécula (ou moléculas) de água. A reação foi mais rápida com o complexo de cobre, e os químicos obtiveram vários tipos de produtos químicos necessários (ligantes e álcool nitrado). O catalisador de cobalto funcionou pior, especialmente na produção de álcool nitrado. Assim, os autores decidiram se concentrar no catalisador de cobre.
Contudo, o uso de um catalisador de cobre no metanol também causou problemas. A formação de álcool nitrado apenas na forma racêmica foi observada durante a condensação. Nesse caso, a taxa de reação não diminuiu, e o bloqueio do centro catalítico do íon cobre não ocorreu. Cálculos mostraram que a água forma uma forte ligação entre o centro de cobre e o grupo carbonila. A reação foi concluída em uma hora, e o rendimento do álcool nitrado atingiu 61%. Ao mesmo tempo, o álcool nitrado foi deslocado pela água e não bloqueou o centro catalítico do complexo de cobre. Assim, ao contrário das ideias anteriores, foi demonstrado que a água aumenta as propriedades catalíticas dos complexos de cobre.
Os químicos concluíram que a eficácia dos catalisadores quirais previamente estudados à base de cobre (II) foi subestimada porque o teor de água (ou álcool) da reação não foi levado em consideração e não foi avaliado. Esta pesquisa abrirá o caminho para estudar o mecanismo da reação de Henry e criar os novos sistemas catalíticos baseados em complexos de cobre.