As estruturas do receptor de quimiocina CX3CR1 revelam o mecanismo de regulação do colesterol na ativação
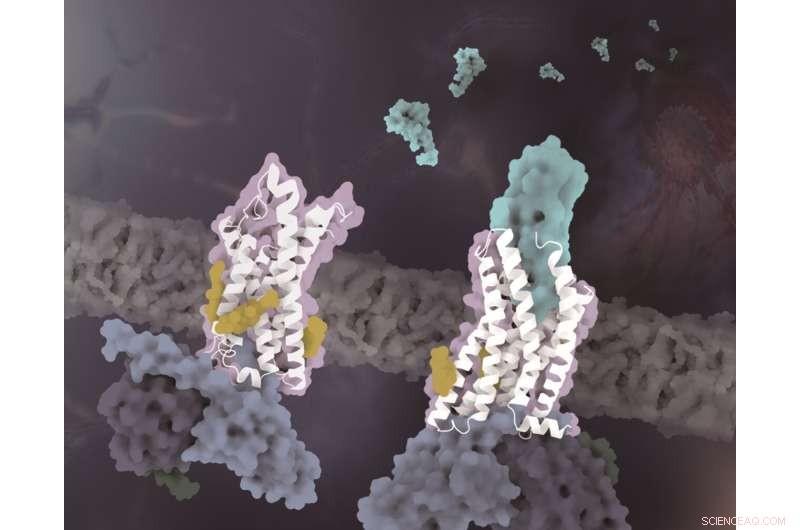
As estruturas de CX3CR1 em estados conformacionais distintos. O CX3CR1 no estado livre de ligante e no estado ligado ao CX3CL1 são de cor branca. O CX3CL1 é de cor ciano, os colesterols são de cor amarela e as três subunidades da proteína G são de cor azul claro, azul escuro e verde escuro, respectivamente. Crédito:Laboratório de Zhao Qiang no SIMM
Os receptores de quimiocinas regulam a migração de células imunes e estão envolvidos na inflamação, construção de tumores e infecção por patógenos. As quimiocinas são divididas em quatro subfamílias de acordo com o número e distribuição de cisteínas conservadas no terminal N:CC, CXC, CX3C e XC.
As quimiocinas reconhecem seus receptores na mesma subfamília que complica o desenvolvimento de drogas direcionadas. Como o único membro da subfamília de receptores de quimiocinas CX3C, o CX3CR1 apresenta uma vantagem única como um potencial alvo de drogas no tratamento de aterosclerose, câncer e neuropatia. No entanto, o desenvolvimento de drogas de CX3CR1 é dificultado parcialmente pela falta de informação estrutural que governa o reconhecimento de quimiocinas e ativação do receptor.
Em um estudo publicado na revista
Science Advances em 29 de junho, uma equipe de pesquisa liderada por Zhao Qiang e Wu Beili do Instituto de Matéria Médica de Xangai (SIMM) da Academia Chinesa de Ciências, fez um avanço no campo dos receptores de quimiocinas, resolvendo as estruturas de microscopia crio-eletrônica de CX3CR1 Complexos -Gi e CX3CR1-CX3CL1-Gi.
Embora várias estruturas complexas de receptores de quimiocinas nas subfamílias CC e CXC tenham sido resolvidas, o mecanismo molecular do reconhecimento exclusivo de CX3CR1 e CX3CL1 permanece desconhecido. Com a análise de estruturas e alinhamento de sequências, os pesquisadores descobriram que as características estruturais únicas do loop 30s em CX3CL1 e da região ECL2 em CX3CR1 desempenham um papel fundamental no reconhecimento com mecanismo de complementaridade de forma. Comparado com as quimiocinas CC e CXC, o motivo específico CX3C de CX3CL1 resulta em um deslocamento maior do loop de 30s em direção ao CX3CR1 ECL2.
Como o ECL2 de CX3CR1 contém menos resíduos do que outros receptores de quimiocina, correspondentemente, o ECL2 mais curto na estrutura CX3CR1-CX3CL1 fornece espaço suficiente para a alça de 30s de CX3CL1. No entanto, a alça de 30s de outras subfamílias de quimiocinas exibe conformação não estendida, que é complementar à superfície de ECL2 mais longa dos receptores correspondentes.
Esta é a primeira vez que os cientistas forneceram a base estrutural para elucidar o mecanismo molecular de reconhecimento específico entre CX3CR1 e seu ligante endógeno exclusivo.
Além da especificidade do reconhecimento do sinal quimiotático, outro achado importante deste estudo revela que as moléculas de colesterol regulam a ativação do CX3CR1. Nas estruturas complexas de ambos os estados ligado a CX3CL1 e constitutivamente ativado, três colesterols foram observados para estabilizar a hélice VI de CX3CR1 com uma mudança conformacional muito menor do que as estruturas do complexo GPCR-Gi classe A previamente resolvidas. Apoiado por dados funcionais de CX3CR1 e outros receptores de quimiocinas, os colesterols são ainda verificados para desempenhar papéis especificamente essenciais na estabilização da conformação e transdução de sinalização de CX3CR1.
Este estudo fornece informações sobre o mecanismo exclusivo de reconhecimento de quimiocinas para a subfamília de receptores de quimiocinas humanas. Os distintos sítios de ligação de colesterol de CX3CR1 aprofundam nosso conhecimento sobre a modulação de colesterol em GPCRs.
+ Explorar mais Cientistas avançam na compreensão dos receptores de serotonina
