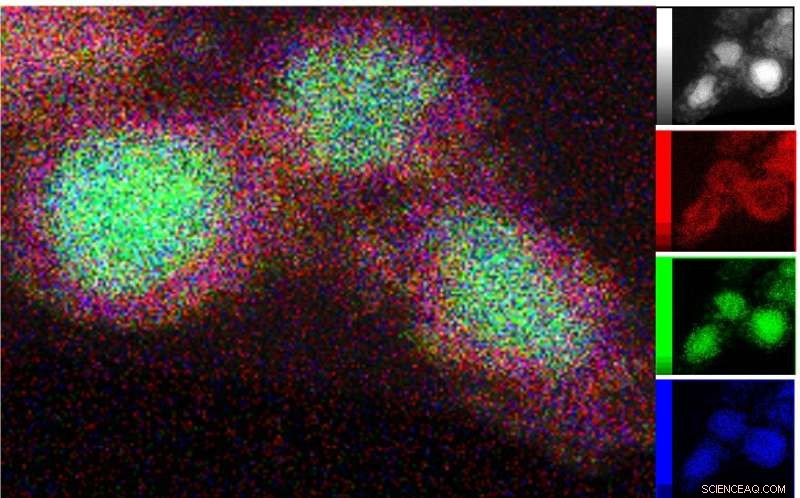
A microscopia eletrônica de transmissão (TEM) da fase cataliticamente ativa foi combinada com espectroscopia de raios-X de energia dispersiva para mapear a distribuição de Ni (verde), Si (azul) e oxigênio (vermelho) ao redor das estruturas núcleo-casca. Crédito:P. Menezes /HZB/TU Berlim
A eletrólise pode ser um conceito familiar das aulas de química na escola:dois eletrodos são imersos em água e colocados sob tensão. Essa voltagem faz com que as moléculas de água se desfaçam em seus componentes, e bolhas de gás sobem nos eletrodos:o gás oxigênio se forma no ânodo, enquanto as bolhas de hidrogênio se formam no cátodo. A eletrólise pode produzir hidrogênio em um CO
2 - maneira neutra - desde que a eletricidade necessária seja gerada por formas de energia livre de fósseis, como sol ou vento.
O único problema é que essas reações não são muito eficientes e extremamente lentas. Para acelerar as reações, são utilizados catalisadores à base de metais preciosos e raros, como platina, rutênio ou irídio. Para uso em larga escala, no entanto, esses catalisadores devem consistir em elementos amplamente disponíveis e muito baratos.
Nanoestruturas quimicamente induzidas Para acelerar a reação de evolução de oxigênio no ânodo, materiais à base de níquel são considerados bons candidatos. O níquel é resistente à corrosão, pouco tóxico e também barato. Até agora, no entanto, os processos de alta temperatura com uso intensivo de energia têm sido usados principalmente para produzir materiais catalisadores à base de níquel.
Uma equipe liderada pelo Dr. Prashanth Menezes (HZB/TU Berlin) descobriu agora uma forma "soft química" de produzir um catalisador eficiente baseado em nanocristais intermetálicos de níquel-silício.
"Combinamos o elemento níquel com o silício, o segundo elemento mais abundante na crosta terrestre, e conseguimos a nanoestruturação por meio de uma reação química. O material resultante tem excelentes propriedades catalíticas", diz Menezes. O Ni
2 cristalino Si serviu como um pré-catalisador para a reação de evolução alcalina de oxigênio no ânodo e sofre transformação de superfície para formar nicke(oxi)hidróxido como um catalisador ativo sob condição de operação. Notavelmente, a eletrólise da água foi ainda combinada com a reação de oxidação orgânica de valor agregado, na qual a eletrossíntese de compostos nitrílicos industrialmente valiosos foi produzida a partir de aminas primárias com conversão seletiva e completa sob condições suaves. Esses métodos eletrossintéticos podem aumentar a geração de hidrogênio no cátodo e simultaneamente fornecer acesso a produtos industriais valiosos no ânodo.
Mais eficiente e estável Comparado aos catalisadores modernos baseados em níquel, cobalto, ferro, rutênio e irídio, o nanoporoso Ni
2 O Si é significativamente mais ativo e permanece estável por mais tempo de reação em condições de nível industrial. Para entender o comportamento do Ni
2 Si com mais detalhes, a equipe combinou diferentes métodos de medição, incluindo análises elementares, microscopia eletrônica e medições espectroscópicas modernas no BESSY II. "No futuro, até mesmo eletrolisadores industriais de água alcalina poderão ser equipados com um revestimento desse silício nanoporoso de níquel", diz Menezes.
A pesquisa foi publicada em
Advanced Energy Materials .
+ Explorar mais O níquel revestido com carbono permite uma célula de combustível de hidrogênio livre de metais preciosos
