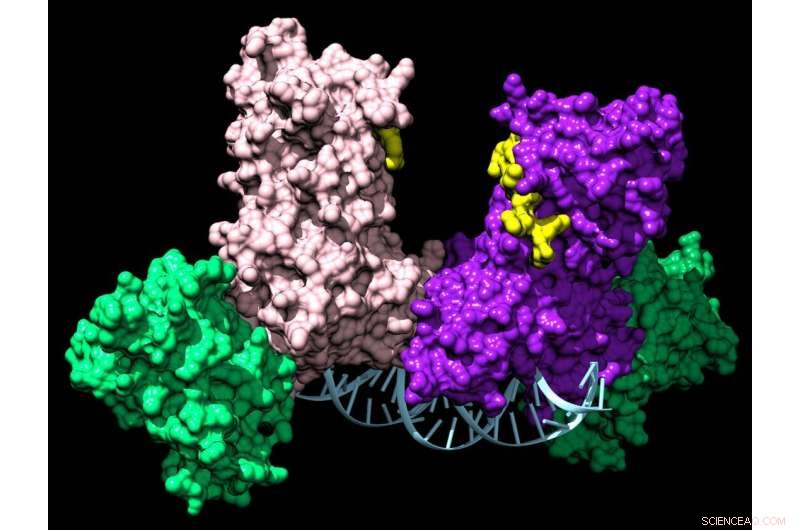
Um par de enzimas DNMT3A une duas proteínas auxiliares (verde) para formar um complexo de quatro partes que viaja ao longo do DNA adicionando marcadores químicos que informam à célula quais genes expressar. Crédito:Jonathan Sandoval et al.
A quimioterapia é uma merda. Os tratamentos geralmente têm efeitos colaterais terríveis, e não é segredo que as drogas envolvidas são frequentemente tóxicas para o paciente, assim como para o câncer. A ideia é que, como os cânceres crescem tão rapidamente, a quimioterapia matará a doença antes que seus efeitos colaterais matem o paciente. É por isso que cientistas e médicos estão constantemente à procura de terapias mais eficazes.
Uma equipe liderada por pesquisadores da UC Santa Barbara e incluindo colaboradores da UC San Francisco e Baylor College of Medicine, identificou dois compostos que são mais potentes e menos tóxicos do que as terapias atuais para leucemia. As moléculas funcionam de maneira diferente dos tratamentos padrão de câncer e podem formar a base de uma classe totalmente nova de medicamentos. Além disso, os compostos já são usados no tratamento de outras doenças, o que reduz drasticamente a quantidade de burocracia envolvida em adaptá-los à leucemia ou até mesmo prescrever off-label. As descobertas aparecem no
Journal of Medicinal Chemistry .
“Nosso trabalho em uma enzima que sofre mutação em pacientes com leucemia levou à descoberta de uma maneira totalmente nova de regular essa enzima, bem como novas moléculas que são mais eficazes e menos tóxicas para as células humanas”, disse o professor da UC Santa Barbara. Norbert Reich, autor correspondente do estudo.
O epigenoma Todas as células do seu corpo contêm o mesmo DNA, ou genoma, mas cada uma usa uma parte diferente desse projeto com base no tipo de célula. Isso permite que diferentes células executem suas funções especializadas enquanto ainda usam o mesmo manual de instruções; essencialmente, eles apenas usam diferentes partes do manual. O epigenoma diz às células como usar essas instruções. Por exemplo, marcadores químicos determinam quais partes são lidas, ditando o destino real de uma célula.
O epigenoma de uma célula é copiado e preservado por uma enzima (um tipo de proteína) chamada DNMT1. Essa enzima garante, por exemplo, que uma célula hepática em divisão se transforme em duas células hepáticas e não em uma célula cerebral.
No entanto, mesmo em adultos, algumas células precisam se diferenciar em diferentes tipos de células do que eram antes. Por exemplo, as células-tronco da medula óssea são capazes de formar todos os diferentes tipos de células sanguíneas, que não se reproduzem por conta própria. Isso é controlado por outra enzima, DNMT3A.
Isso é muito bom até que algo dê errado com o DNMT3A, fazendo com que a medula óssea se transforme em células sanguíneas anormais. Este é um evento primário que leva a várias formas de leucemia, bem como a outros tipos de câncer.
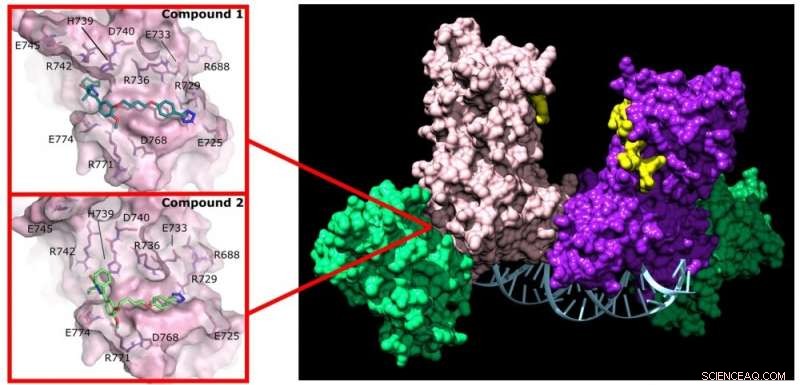
A pirazolona (composto 1) e a piridazina (composto 2) interrompem a atividade de DNMT3A ligando-se a um sítio não ativo na enzima. Crédito:Jonathan Sandoval et al.
Tratamentos tóxicos A maioria dos medicamentos contra o câncer são projetados para matar seletivamente as células cancerígenas, deixando as células saudáveis em paz. Mas isso é extremamente desafiador, e é por isso que muitos deles são extremamente tóxicos. Os tratamentos atuais de leucemia, como o Decitabine, se ligam ao DNMT3A de uma maneira que o desativa, retardando assim a progressão da doença. Eles fazem isso obstruindo o sítio ativo da enzima (essencialmente, seu fim de negócios) para impedi-la de realizar sua função.
Infelizmente, o sítio ativo do DNMT3A é praticamente idêntico ao do DNMT1, então a droga desliga a regulação epigenética em todas as 30 a 40 trilhões de células do paciente. Isso leva a um dos maiores gargalos da indústria farmacêutica:toxicidade fora do alvo.
Entupimento do sítio ativo de uma proteína é uma maneira direta de colocá-la offline. É por isso que o sítio ativo geralmente é o primeiro lugar que os designers de medicamentos procuram ao projetar novos medicamentos, explicou Reich. No entanto, cerca de oito anos atrás, ele decidiu investigar compostos que poderiam se ligar a outros locais em um esforço para evitar efeitos fora do alvo.
Trabalhando juntos Enquanto o grupo investigava o DNMT3A, eles notaram algo peculiar. Enquanto a maioria dessas enzimas relacionadas à epigenética funciona por conta própria, o DNMT3A sempre formou complexos, seja consigo mesmo ou com proteínas parceiras. Esses complexos podem envolver mais de 60 parceiros diferentes e, curiosamente, eles atuam como dispositivos de direcionamento para direcionar o DNMT3A para controlar genes específicos.
Os primeiros trabalhos no laboratório do Reich, liderados pela ex-estudante de pós-graduação Celeste Holz-Schietinger, mostraram que a interrupção do complexo por meio de mutações não interferiu em sua capacidade de adicionar marcadores químicos ao DNA. No entanto, o DNMT3A se comportou de forma diferente quando estava sozinho ou em um par simples; não era para ficar no DNA e marcar um local após o outro, o que é essencial para sua função celular normal.
Na mesma época, o
New England Journal of Medicine fez um mergulho profundo nas mutações presentes em pacientes com leucemia. Os autores desse estudo descobriram que as mutações mais frequentes em pacientes com leucemia mieloide aguda estão no gene DNMT3A. Surpreendentemente, Holz-Schietinger havia estudado exatamente as mesmas mutações. A equipe agora tinha uma ligação direta entre DNMT3A e as alterações epigenéticas que levam à leucemia mielóide aguda.
Descobrindo um novo tratamento Reich e seu grupo se interessaram em identificar drogas que pudessem interferir na formação de complexos DNMT3A que ocorrem em células cancerígenas. Eles obtiveram uma biblioteca química contendo 1.500 medicamentos previamente estudados e identificaram dois que interrompem as interações de DNMT3A com proteínas parceiras (inibidores de proteína-proteína, ou PPIs).
Além disso, essas duas drogas não se ligam ao sítio ativo da proteína, portanto, não afetam a DNMT1 em ação em todas as outras células do corpo. "Essa seletividade é exatamente o que eu esperava descobrir com os alunos deste projeto", disse Reich.
Esses medicamentos são mais do que apenas um avanço potencial no tratamento da leucemia. Eles são uma classe completamente nova de drogas:inibidores de proteína-proteína que têm como alvo uma parte da enzima longe de seu sítio ativo. "Um IBP alostérico nunca foi feito antes, pelo menos não para um alvo de droga epigenética", disse Reich. "Isso realmente colocou um sorriso no meu rosto quando obtivemos o resultado."
Essa conquista não é tarefa fácil. "Desenvolver pequenas moléculas que interrompem as interações proteína-proteína provou ser um desafio", observou o principal autor Jonathan Sandoval da UC San Francisco, ex-aluno de doutorado no laboratório de Reich. "Estes são os primeiros inibidores relatados de DNMT3A que interrompem as interações proteína-proteína".
Os dois compostos que a equipe identificou já foram usados clinicamente para outras doenças. Isso elimina muitos custos, testes e burocracia envolvidos em desenvolvê-los em terapias de leucemia. Na verdade, os oncologistas poderiam prescrever esses medicamentos para pacientes fora do rótulo agora.
Desenvolvendo o sucesso No entanto, ainda há mais para entender sobre essa nova abordagem. A equipe quer aprender mais sobre como os inibidores de proteína-proteína afetam os complexos DNMT3A em células saudáveis da medula óssea. Reich está colaborando com o professor de química da UC Santa Barbara, Tom Pettus, e um estudante de doutorado conjunto deles, Ivan Hernandez. "Estamos fazendo mudanças nas drogas para ver se podemos melhorar ainda mais a seletividade e a potência", disse Reich.
Há também mais para aprender sobre os efeitos a longo prazo das drogas. Como os compostos trabalham diretamente nas enzimas, eles podem não alterar as mutações subjacentes que causam o câncer. Essa ressalva afeta como os médicos podem usar esses medicamentos. "Uma abordagem é que um paciente continuaria a receber doses baixas", disse Reich. "Como alternativa, nossa abordagem pode ser usada com outros tratamentos, talvez para reduzir a carga tumoral a um ponto em que interromper o tratamento seja uma opção".
Reich também admite que a equipe ainda precisa saber qual o efeito dos IBPs na diferenciação da medula óssea a longo prazo. Eles estão curiosos para saber se as drogas podem provocar algum tipo de memória celular que possa mitigar problemas no nível epigenético ou genético.
Dito isto, Reich está animado por sua descoberta. "Ao não visar o sítio ativo do DNMT3A, já estamos muito além do medicamento atualmente usado, o Decitabine, que é definitivamente citotóxico", disse ele, acrescentando que esse tipo de abordagem também pode ser adaptado para outros tipos de câncer.
+ Explorar mais Os cientistas encontram uma ligação surpreendente entre o DNA mitocondrial e o aumento do risco de aterosclerose

