Uma nova via metabólica da L-fucose de bactérias estritamente anaeróbicas e patogênicas
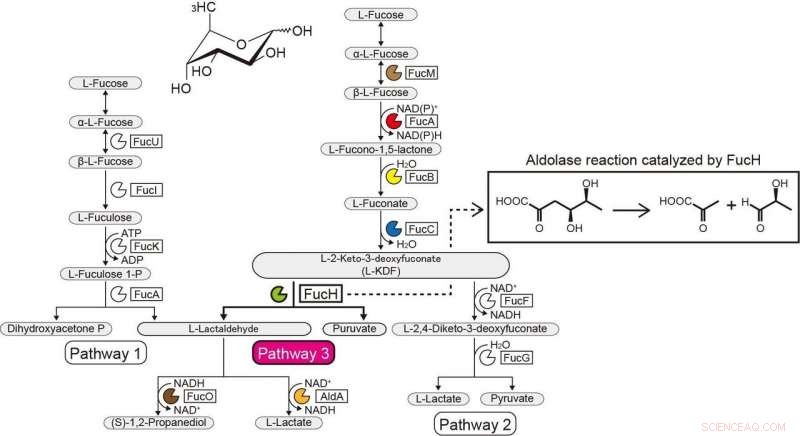 p Vias metabólicas da L-Fucose. Crédito:Ehime University
p Vias metabólicas da L-Fucose. Crédito:Ehime University
p O contexto genético em genomas bacterianos e a seleção de substratos em potencial podem ajudar a identificar as funções bioquímicas das enzimas bacterianas. O Gram-negativo, a bactéria estritamente anaeróbia Veillonella ratti possui um grupo de genes que parece estar relacionado ao metabolismo da L-fucose e contém uma suposta proteína dihidrodipicolinato sintase DHDPS / NAL (FucH). Aqui, o rastreio de uma biblioteca de ácidos 2-ceto-3-desoxisacar com esta proteína e a caracterização bioquímica de genes vizinhos revelou que este agrupamento de genes codifica enzimas numa via de L-fucose não fosforiladora "Via I" previamente desconhecida. p Estudos anteriores de outras aldolases na superfamília de proteínas DHDPS / NAL usaram apenas um número limitado de compostos, e a abordagem aqui relatada permitiu elucidar as especificidades do substrato e seletividades estereoquímicas dessas aldolases e compará-las com as de FucH. De acordo com a reação de clivagem do aldol, as aldolases eram específicas para grupos estereoespecíficos (R) - e (S) na posição C4 do ácido 2-ceto-3-desoxi açúcar, mas não tinha especificidade estrutural ou preferência para os grupos metil nas posições C5 e C6, respectivamente.
p Esta categorização correspondeu à seletividade (Re) - ou (Si) -facial da piruvato enamina no (glicer) aldeído carbonil na reação de condensação de aldol. Essas propriedades são comumente determinadas pelo fato de um resíduo de serina ou treonina estar posicionado na posição equivalente perto do (s) sítio (s) ativo (s), e a mutagênese dirigida ao sítio marcadamente modificou a preferência C4-OH e a formação seletiva de um diastereômero. Propomos que a especificidade do substrato das aldolases ácidas 2-ceto-3-desoxi-açúcares foi adquirida de forma convergente durante a evolução e relatamos a descoberta de outra L-2-ceto-3-desoxifuconato aldolase envolvida na mesma via não fosforiladora da L-fucose em Campylobacter jejuni .
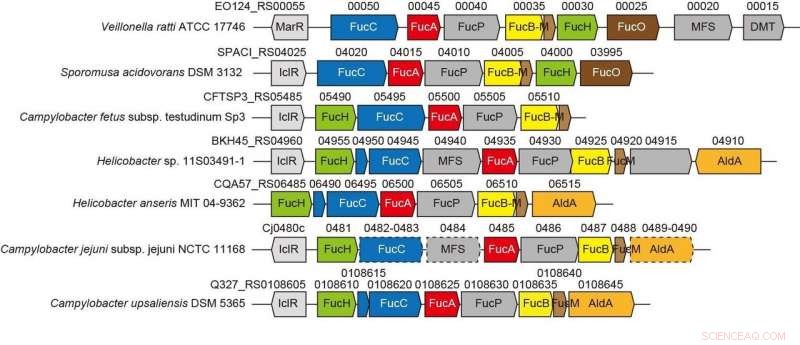 p Aglomerados de genes relacionados à nova via não fosforilativa da L-fucose de bactérias anaeróbias e patogênicas. Crédito:Ehime University
p Aglomerados de genes relacionados à nova via não fosforilativa da L-fucose de bactérias anaeróbias e patogênicas. Crédito:Ehime University

