 p Resumo gráfico. Crédito:DOI:10.1016 / j.cej.2021.131439
p Resumo gráfico. Crédito:DOI:10.1016 / j.cej.2021.131439
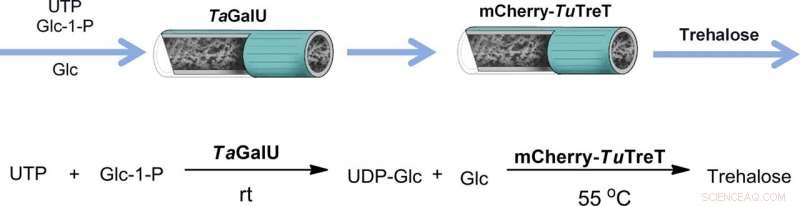
p Enzimas (por exemplo, aqueles derivados de bactérias) podem converter uma ampla variedade de materiais de partida em uma grande variedade de produtos alvo. A chamada biotecnologia branca visa aproveitar essa capacidade de produzir produtos químicos de maneira ecologicamente correta. Uma vez que às vezes são necessários vários catalisadores e etapas para produzir o produto desejado, A equipe de Dirk Tischler projetou uma cascata para catálise de fluxo, em cooperação com grupos da Delft University of Technology, a Universidade Técnica Bergakademie Freiberg e a Universidade de Tecnologia da Silésia. p Os materiais de partida glicose e glicose-1-fosfato (forma ativada) e UTP (trifosfato de uridina, um transportador de energia bioquímica) foram então convertidos em trealose em duas etapas que ocorreram em enzimas imobilizadas. A primeira enzima tem a função de ativar as moléculas de glicose, o segundo os conecta. "Uma vez que uma enzima requer condições de trabalho diferentes da outra, nós os imobilizamos em dois reatores sequenciais, "explica Dirk Tischler. Isso permite aos pesquisadores, por exemplo, para ajustar a temperatura ou o tempo de residência dos substratos no reator independentemente um do outro. "Também seria concebível não apenas ligar açúcares usando este método, mas também, por exemplo, para cultivar agentes medicinais com açúcar, como antibióticos, " ele diz, lançando um olhar para o futuro.
p
Impressão de substratos reutilizáveis
p Em um projeto de acompanhamento, que ele financiou junto com a empresa Hirsch Engineering Solutions e que é apoiado pelo Ministério Federal de Economia e Energia, ele agora se concentra na otimização da cascata. O objetivo é, em primeiro lugar, para melhorar os materiais de substrato para as enzimas. "Os substratos de silicato que usamos até agora não são igualmente bem tolerados por todas as enzimas, "diz Tischler. Além disso, muitas vezes não são reutilizáveis. Plásticos, incluindo aqueles de fontes biológicas, pode ser mais adequado e pode ser moldado por impressão 3D. "Eles já provaram sua biocompatibilidade em várias aplicações médicas, "aponta o cientista.
p Em segundo lugar, os parceiros do projeto também querem tornar a cascata de enzimas mais econômica, adicionando uma quinase que recicla o UDP separado em UTP no final da reação com a ajuda de polifosfato. Como resultado, a cascata pode começar de novo. "Até agora, sempre tivemos que adicionar um novo UTP para iniciar a cascata, que é bastante caro, "explica Dirk Tischler." Se pudéssemos reciclá-lo por meio de polifosfato, os custos seriam consideravelmente reduzidos. "
