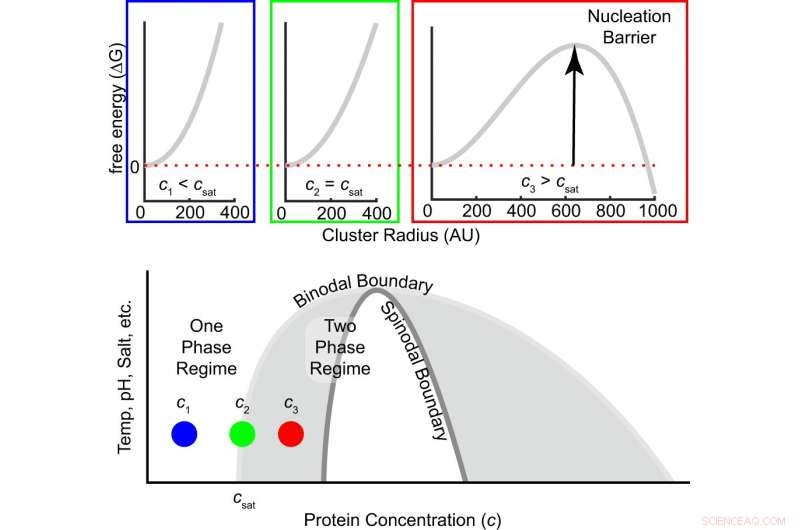
 p Fig. 1:A barreira de energia livre para nucleação depende do grau de supersaturação. A energia livre em função do tamanho do cluster é mostrada no topo para três concentrações, ou seja, abaixo, igual ou superior à concentração de saturação. À medida que a concentração aumenta de subsaturada para a concentração de saturação para supersaturada, o sinal da diferença de energia livre entre uma molécula dentro e fora de um cluster muda de positivo para negativo, e uma barreira de nucleação finita emerge (Eq. (1)). A região cinza dentro do binodal é metaestável, o que significa que a nucleação é necessária para formar grupos de fase densa que crescem até que o equilíbrio seja alcançado. O regime branco dentro do espinodal é instável, o que significa que a solução se decompõe espontaneamente em fases diluídas e densas. Crédito:DOI:10.1038 / s41467-021-24727-z
p Fig. 1:A barreira de energia livre para nucleação depende do grau de supersaturação. A energia livre em função do tamanho do cluster é mostrada no topo para três concentrações, ou seja, abaixo, igual ou superior à concentração de saturação. À medida que a concentração aumenta de subsaturada para a concentração de saturação para supersaturada, o sinal da diferença de energia livre entre uma molécula dentro e fora de um cluster muda de positivo para negativo, e uma barreira de nucleação finita emerge (Eq. (1)). A região cinza dentro do binodal é metaestável, o que significa que a nucleação é necessária para formar grupos de fase densa que crescem até que o equilíbrio seja alcançado. O regime branco dentro do espinodal é instável, o que significa que a solução se decompõe espontaneamente em fases diluídas e densas. Crédito:DOI:10.1038 / s41467-021-24727-z
p Cientistas do St. Jude Children's Research Hospital estão estudando a separação de fase líquido-líquido (LLPS), um processo biofísico por meio do qual proteínas e ácidos nucléicos em uma célula são compartimentados sem membrana. O trabalho fornece uma nova visão sobre como a intensidade das forças que impulsionam a separação de fases está ligada à velocidade em que ela ocorre. Os resultados foram publicados hoje em
Nature Communications . p As células precisam classificar e organizar proteínas e outros componentes. Uma maneira de fazer isso é por meio de LLPS, um processo semelhante à forma como o óleo forma gotas na água. Organelas sem membrana, corpos em uma célula que se comportam como gotículas de líquido, organizar certas proteínas sem envolvê-las com uma membrana. Em vez de, as proteínas são mantidas juntas pelas forças biofísicas que conduzem o LLPS.
p Pouco se sabe sobre como as biomoléculas fazem a transição de uma solução monofásica para uma mistura de duas fases, em um processo chamado nucleação. Este processo tem sido desafiador para avaliar porque requer a observação de escalas de tempo extremamente rápidas (microssegundos a milissegundos). Como resultado, a maioria dos estudos olhou para a evolução dentro de sistemas que já estão no regime de duas fases (como as gotículas se fundem e crescem).
p "Podemos ver durante esses momentos iniciais que mesmo moléculas de proteínas desordenadas individuais que se separam de fase têm propriedades bastante diferentes das proteínas desordenadas que não se separam de fase, "disse a co-autora Tanja Mittag, Ph.D., St. Jude Department of Structural Biology.
p Pesquisas na St. Jude e em outros lugares mostraram que o LLPS pode estar envolvido em doenças neurodegenerativas, como esclerose lateral amiotrófica (ELA) e câncer. Uma melhor compreensão do LLPS pode, em última análise, levar a oportunidades para direcionar terapeuticamente partes do processo.
p
As medições de microssegundos fornecem uma nova compreensão
p A visão predominante de LLPS em biologia tem sido que uma mudança nas condições celulares pode levar espontaneamente à nucleação, mudar uma solução monofásica em duas fases. Nesta pesquisa, os cientistas usaram um sistema simplificado, com uma única proteína em água e sal, para estudar se a mudança realmente ocorreu dessa maneira ou se etapas adicionais são necessárias para iniciar o processo.
p Com uma técnica chamada mistura rápida, resolvido no tempo, espalhamento de raios-X de baixo ângulo (TR-SAXS), os pesquisadores puderam observar os primeiros estágios do processo. Eles examinaram a nucleação de um domínio semelhante a príon denominado A1-LCD da proteína hnRNPA1. Mutações nesta proteína causam ALS e outras doenças.
p Os cientistas mostraram como os clusters de A1-LCD se formam, e como esses clusters levam ao LLPS. Os resultados indicam que a nucleação contém etapas distintas, diferenciados pelo tamanho do cluster. Ao olhar para os menores clusters (com poucas moléculas individuais), os cientistas descobriram que o comportamento de montagem diferia da teoria clássica da nucleação. Esses desvios explicam potencialmente por que a separação de fases de algumas biomoléculas pode acontecer em milissegundos, enquanto outras leva horas.
p "Mesmo em um sistema simplificado, você ainda tem que levar em consideração esse tipo de efeito não ideal nos estágios iniciais da nucleação, "disse o co-autor Erik Martin, Ph.D., St. Jude Department of Structural Biology. "Antes que você possa começar a pensar sobre a montagem de separação de fase ou condensação nas células, você precisa pensar sobre as coisas em um nível molecular. Haverá etapas iniciais para essa montagem que não foram consideradas nos modelos anteriores. "
