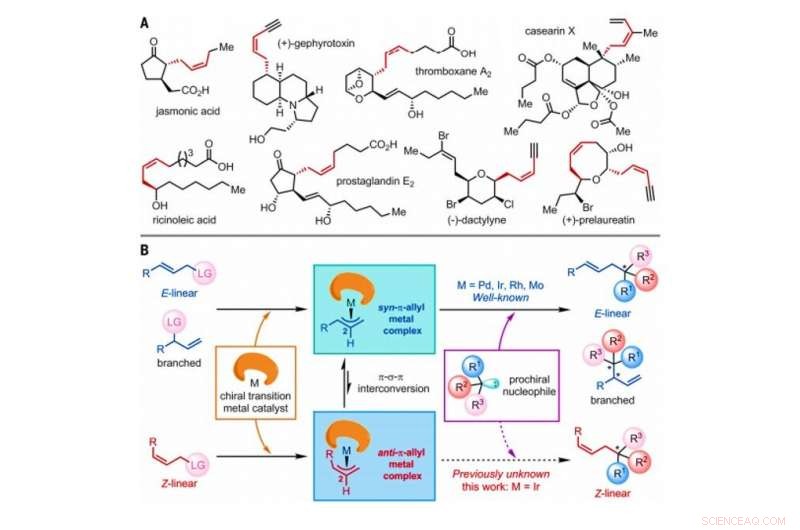
 p Estratégia para a construção de Z-olefinas via reações assimétricas de substituição alílica catalisadas por catalisadores de metais de transição. (A) Produtos naturais selecionados contendo Z-olefinas com estereocentros homoalílicos. Mim, metilo. (B) Mecanismo geral proposto de reações de substituição alílica assimétrica catalisada por metal de transição envolvendo E-linear, ramificado, ou substratos de olefina Z-linear, todos os quais incluem um átomo ou grupo de átomos denotados como um grupo de saída (LG). Crédito:Ciência, doi:10.1126 / science.abd6095
p Estratégia para a construção de Z-olefinas via reações assimétricas de substituição alílica catalisadas por catalisadores de metais de transição. (A) Produtos naturais selecionados contendo Z-olefinas com estereocentros homoalílicos. Mim, metilo. (B) Mecanismo geral proposto de reações de substituição alílica assimétrica catalisada por metal de transição envolvendo E-linear, ramificado, ou substratos de olefina Z-linear, todos os quais incluem um átomo ou grupo de átomos denotados como um grupo de saída (LG). Crédito:Ciência, doi:10.1126 / science.abd6095
p Na química orgânica sintética, As Z-olefinas são um alvo sintético desafiador para produzir em laboratório devido à sua relativa instabilidade termodinâmica. As Z-olefinas formam um composto insaturado com um C
n H
2n fórmula que pode ser facilmente isomerizada. Reações análogas usadas para sintetizar produtos de Z-olefina opticamente ativos são raras. Em um novo relatório agora publicado em
Ciência , Ru Jiang e uma equipe de pesquisa da Universidade da Academia Chinesa de Ciências em Xangai, China, detalhou uma reação de substituição alílica assimétrica catalisada por irídio para reter geometrias de Z-olefina ao estabelecer um estereocentro quaternário adjacente. A equipe observou a formação de intermediários anti-π-alil-irídio transientes e sua captura por nucleófilos externos (doadores de elétrons) antes da isomerização para formar contrapartes sin-π-alil-irídio termodinamicamente mais estáveis. Os resultados fornecem um método promissor para preparar compostos quirais de Z-olefina em laboratório. p
Olefinas
p O isômero geométrico tipo Z das olefinas é amplamente observado como estruturas básicas na natureza. No entanto, Z-olefinas são comparativamente menos estáveis quando comparadas com suas contrapartes do tipo E, e portanto, é difícil sintetizá-los seletivamente em química orgânica. Métodos comuns para acessar Z-olefinas incluem a isomerização fotoinduzida de E-olefinas, Witting olefination, Metátese cruzada Z-seletiva, Acoplamento cruzado retentivo Z e adição assimétrica de nucleófilos Z-alilboron a cetonas e iminas. As Z-olefinas com um estereocentro homoalílico são frequentemente incorporadas em diversos produtos naturais e moléculas bioativas para gerar um interesse considerável na química orgânica sintética. Os pesquisadores demonstraram a capacidade de conduzir reações de substituição alílica assimétricas catalisadas por metais de transição, incluindo molibdênio (Mo), paládio (Pd), irídio (Ir) e ródio (Rh). Desde seu primeiro relatório em 1997, As reações de substituição alílicas assimétricas catalisadas por Ir têm atraído atenção intensa devido à sua natureza regio e enantiosseletiva excepcionalmente alta. Nesse trabalho, Jiang et al. relataram reações de substratos alílicos Z-lineares com triptaminas e triptofol. Durante a análise abrangente dos mecanismos de reação, eles notaram a formação de complexos chave anti-π-alil-irídio, antes da isomerização para formar as contrapartes sin-π-alil-irídio termodinamicamente estáveis.
p
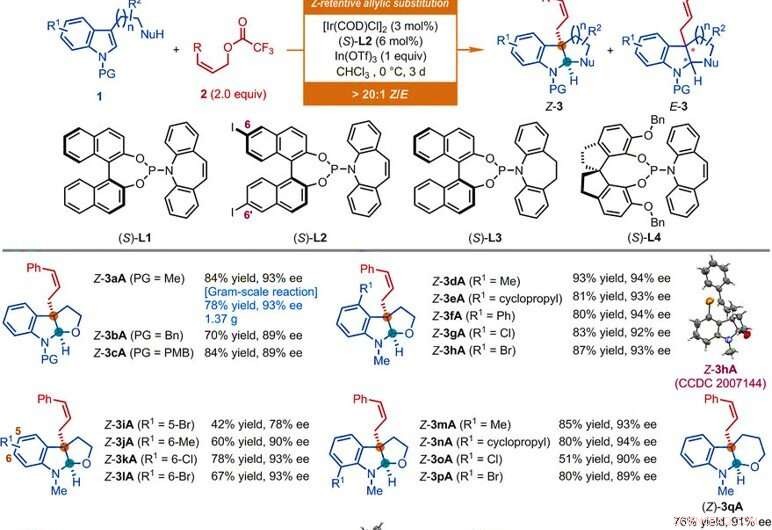 p Âmbito de substrato de reações de substituição alílica assimétricas retentivas em Z catalisadas por Ir de derivados de indol. Todas as reações foram conduzidas de acordo com as condições fornecidas aqui, exceto quando indicado. A razão geométrica do tipo Z para o tipo E (Z / E) e a razão diastereomérica (dr) foram determinadas por análise de 1H NMR das misturas brutas. Os rendimentos isolados de Z-3 são relatados. Os valores de ee foram determinados por análise de cromatografia líquida de alta eficiência (HPLC) com uma fase estacionária quiral. O asterisco indica uma razão Z / E de 7:1. O símbolo de uma adaga indica uma proporção Z / E de 8:1. O símbolo de punhal duplo indica que as reações foram conduzidas durante 1 dia. O símbolo da seção indica uma proporção Z / E de 11:1. O símbolo do parágrafo indica que as reações foram conduzidas usando acetato de (Z) -non-2-en-1-il, [Ir (COD) Cl] 2 (3% molar), (S) -L1 (6 mol%), InBr3 (1,0 equiv), e brometo de tetrabutilamónio (0,5 equiv) em CHCI3 a 0 ° C. O símbolo de libra indica que as reações foram conduzidas usando os acetatos Z-alílicos correspondentes, [Ir (COD) Cl] 2 (4,5 mol%), (S) -L2 (9 mol%), In (OTf) 3 (0,5 equiv para Z-3aS e Z-3aT; 1 equiv para Z-3aU) em CHCl3 a -10 ° C por 2 dias. Bn, benzil; Bu, butilo; Et, etilo; Em, mesil; Ph, fenil; PMB, para-metoxibenzil; p-Tol, para-tolil; Ts, tosyl. Crédito:Ciência, doi:10.1126 / science.abd6095
Processo sintético
p Âmbito de substrato de reações de substituição alílica assimétricas retentivas em Z catalisadas por Ir de derivados de indol. Todas as reações foram conduzidas de acordo com as condições fornecidas aqui, exceto quando indicado. A razão geométrica do tipo Z para o tipo E (Z / E) e a razão diastereomérica (dr) foram determinadas por análise de 1H NMR das misturas brutas. Os rendimentos isolados de Z-3 são relatados. Os valores de ee foram determinados por análise de cromatografia líquida de alta eficiência (HPLC) com uma fase estacionária quiral. O asterisco indica uma razão Z / E de 7:1. O símbolo de uma adaga indica uma proporção Z / E de 8:1. O símbolo de punhal duplo indica que as reações foram conduzidas durante 1 dia. O símbolo da seção indica uma proporção Z / E de 11:1. O símbolo do parágrafo indica que as reações foram conduzidas usando acetato de (Z) -non-2-en-1-il, [Ir (COD) Cl] 2 (3% molar), (S) -L1 (6 mol%), InBr3 (1,0 equiv), e brometo de tetrabutilamónio (0,5 equiv) em CHCI3 a 0 ° C. O símbolo de libra indica que as reações foram conduzidas usando os acetatos Z-alílicos correspondentes, [Ir (COD) Cl] 2 (4,5 mol%), (S) -L2 (9 mol%), In (OTf) 3 (0,5 equiv para Z-3aS e Z-3aT; 1 equiv para Z-3aU) em CHCl3 a -10 ° C por 2 dias. Bn, benzil; Bu, butilo; Et, etilo; Em, mesil; Ph, fenil; PMB, para-metoxibenzil; p-Tol, para-tolil; Ts, tosyl. Crédito:Ciência, doi:10.1126 / science.abd6095
Processo sintético
p Os pesquisadores investigaram primeiro a reação de desaromatização alílica assimétrica envolvendo nucleófilos como N-metil triptofol com derivados Z-cinamil. Usando acetato de Z-cinamila, eles alcançaram a reação desejada com um catalisador derivado de dímero de cloro de irídio ciclooctadieno (COD) na presença de outros compostos sintéticos. Os cientistas obtiveram o produto alvo com rendimento moderado e enantiosseletividade com uma razão geométrica do tipo Z para o tipo E de 2:1. Em seguida, eles otimizaram os constituintes para melhorar a qualidade e o rendimento dos produtos sintéticos. Com base na reação de substituição alílica assimétrica retentiva Z proposta, Jiang et al. obteve compatibilidade de diversos grupos funcionais que toleravam um amplo escopo de substrato. A equipe sintetizou com sucesso mais de 50 exemplos de (homo) triptofóis, triptaminas e substratos de indol contendo um nucleófilo pendente à base de carbono usando derivados de Z-cinamila. Quase todas as reações forneceram um rendimento de razões de tipo Z para tipo E maiores do que 20:1. Os exemplos incluem as furoindolinas Z-cinamiladas correspondentes (abreviadas de Z-3aA a Z-3pA), tetrahidropiranindolina (abreviado como Z-3qA), pirroloindolinas (abreviado de Z-3a'A a Z-3o'A) e hexahidrociclopentaindoles (abreviado de Z-3a′′A a Z-3c′′A) com bons rendimentos de até 94 por cento. Geralmente, a substituição de propriedades eletrônicas e estéricas variadas nas posições disponíveis do anel indol não teve impacto deletério na eficiência ou enantiosseletividade da reação. Os pesquisadores estabeleceram as estruturas e a configuração absoluta dos produtos por meio da análise cristalográfica de raios-X. Eles também examinaram o desempenho dos derivados D- e L-triptofano.
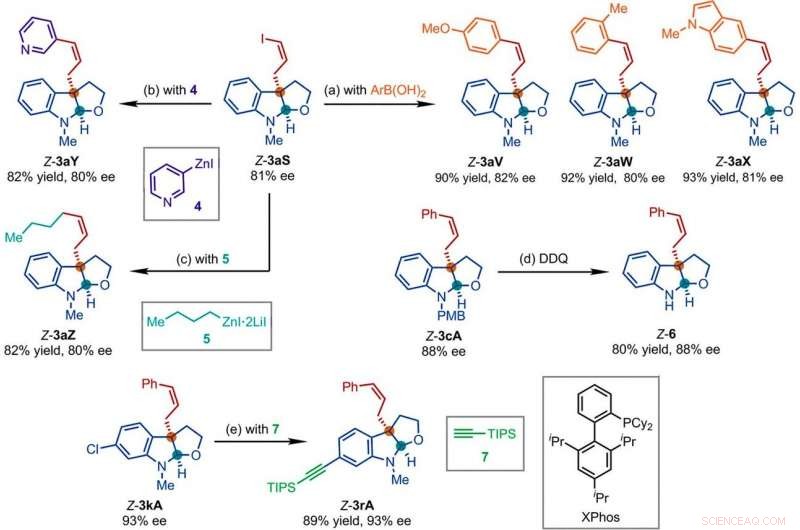 p Produtos representativos obtidos em reações subsequentes com os produtos da reação de substituição alílica assimétrica retentiva Z catalisada por Ir. Condições de reação:(a) Pd (PPh3) 4 (0,5 mol%), Cs2CO3 (2 equiv), ArB (OH) 2 (1,5 equiv), acetonitrila, 50 ° C; (b) 4 (2 equiv), THF / diglima (1:1), 110 ° C, 24 horas; (c) 5 (2 equiv), LiCl (4 equiv), tolueno / THF / TMU, 110 ° C, 24 horas; (d) DDQ (1,5 equiv), CH2Cl2, NaH2PO4 (aquoso 1 M); (e) 7 (2 equiv), PdCl2 (CH3CN) 2 (5 mol%), XPhos (15% molar), Cs2CO3 (2,5 equiv), acetonitrila, 80 ° C. Ar, arilo; THF, tetrahidrofurano; PONTAS, triisopropilsililo; TMU, 1, 1, 3, 3-tetrametilureia. Crédito:Ciência, doi:10.1126 / science.abd6095
p Produtos representativos obtidos em reações subsequentes com os produtos da reação de substituição alílica assimétrica retentiva Z catalisada por Ir. Condições de reação:(a) Pd (PPh3) 4 (0,5 mol%), Cs2CO3 (2 equiv), ArB (OH) 2 (1,5 equiv), acetonitrila, 50 ° C; (b) 4 (2 equiv), THF / diglima (1:1), 110 ° C, 24 horas; (c) 5 (2 equiv), LiCl (4 equiv), tolueno / THF / TMU, 110 ° C, 24 horas; (d) DDQ (1,5 equiv), CH2Cl2, NaH2PO4 (aquoso 1 M); (e) 7 (2 equiv), PdCl2 (CH3CN) 2 (5 mol%), XPhos (15% molar), Cs2CO3 (2,5 equiv), acetonitrila, 80 ° C. Ar, arilo; THF, tetrahidrofurano; PONTAS, triisopropilsililo; TMU, 1, 1, 3, 3-tetrametilureia. Crédito:Ciência, doi:10.1126 / science.abd6095
p
Transformações downstream
p Os pesquisadores estudaram a seguir como uma série de produtos da reação de substituição alílica assimétrica retentiva de Z podem ser prontamente investigados em diversas transformações a jusante. Por exemplo, o iodeto Z-vinil de furoindolinas quirais (abreviado como Z-3aS) foi reativo para ácidos arilborônicos e reagentes de organozinco. Isso forneceu uma rota alternativa para a produção de produtos representativos catalisados por Ir, Z-retentive asymmetric allylic substitution reactions with high yields of up to 82 to 93%. The scientists evaluated the proposed Z-retentive asymmetric allylic substitution reactions by a series of analyses. They obtained the Z-cinnamylated furoindolines (Z-3aA) product with optimal results in the presence of iridium atoms in the catalyst in a molar ratio of 1:1. They then characterized the key intermediates in the catalytic cycle and elucidated their structures using nuclear magnetic resonance (NMR) spectroscopy alongside X-ray crystallographic analysis. The team also monitored the reactions using electrospray ionization mass spectrometry and mechanistic studies. These results showed the isomerization of the complex from an anti- to the syn-π-allyl-iridium complex. Collectively, the analyses showed how the proposed Z-retentive asymmetric allylic substitution reaction successfully originated from the rapid and enantioselective capture of the transient anti-π-allyl-iridium complex by external nucleophiles, before converting it to more thermodynamically stable species.
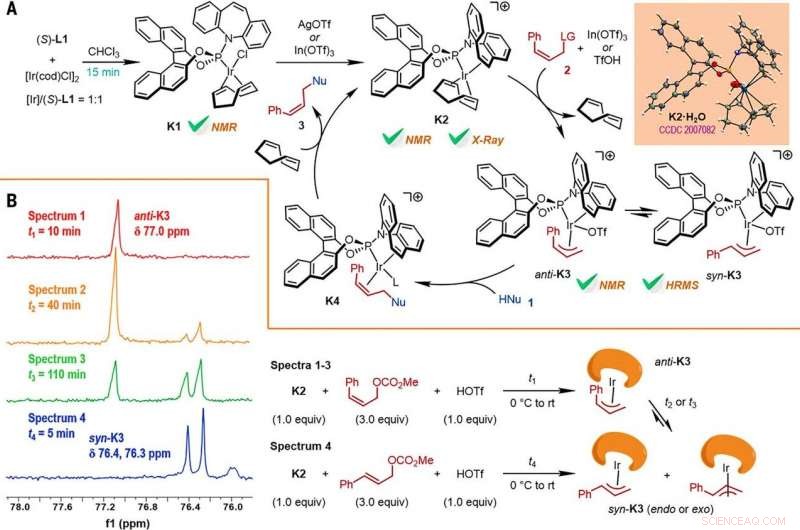 p Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Credit:Science, doi:10.1126/science.abd6095
p Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Credit:Science, doi:10.1126/science.abd6095
p
Exploring the synthetic spectrum
p The scientists also explored the extension of this iridium-catalyzed Z-retentive asymmetric allylic substitution reaction to other nucleophiles. Aside from the iridium catalysts containing Carreira-type chiral ligands that function under acidic conditions, they explored Ir catalysts derived from a Feringa-type chiral phosphoramidite ligand applied under basic conditions for this reaction mode. Como resultado, Jiang et al. used diverse nucleophiles beyond tryptophols and tryptamines. Neste caso, they formed the prochiral nucleophiles from a copper (Cu) source. The independently prepared chiral cyclometallated Ir complex promoted the development of the transient anti-π-allyl-iridium complexes as well as their regio- and enantio-selective captures. The broad scope of the reaction presented more than 30 synthetic samples in good yields with excellent enantioselectivity. The scientists investigated the structure and absolute configuration of the products using X-ray crystallographic analyses. When the team used Z-cinnamyl acetate, they obtained a mixture of the desired Z-cinnamylated product and its branched isomer. The results highlighted the possibility of using the proposed protocol to accommodate diverse prochiral nucleophiles in asymmetric allylic substitution reactions. The researchers expect the work to evolve into a broadly practical method to synthesize chiral Z-olefins in the lab.
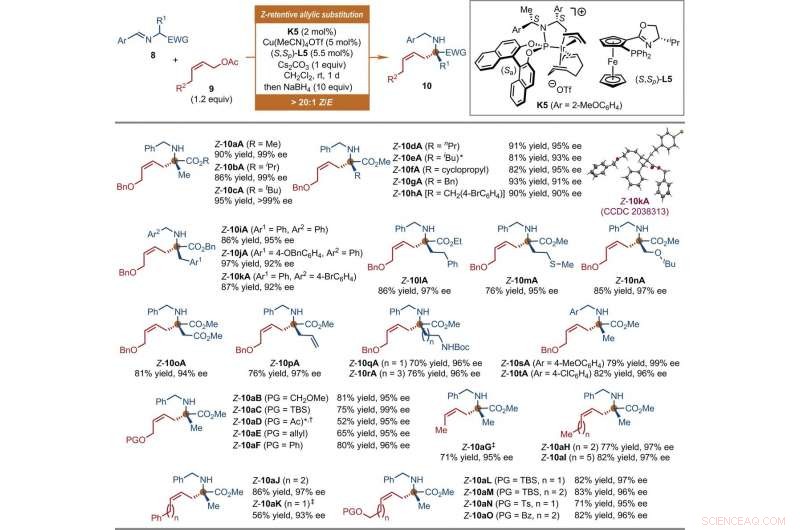 p Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; TBS, tert-butyldimethylsilyl. Credit:Science, doi:10.1126/science.abd6095
p Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; TBS, tert-butyldimethylsilyl. Credit:Science, doi:10.1126/science.abd6095
p © 2021 Science X Network




