 p Um diagrama que ilustra a acetilação da enzima helicase Pif1. Crédito:Matthew Bochman e Lata Balakrishnan, Indiana University Bloomington / IUPUI
p Um diagrama que ilustra a acetilação da enzima helicase Pif1. Crédito:Matthew Bochman e Lata Balakrishnan, Indiana University Bloomington / IUPUI
p Um novo estudo liderado por cientistas da IUPUI e da Indiana University Bloomington é o primeiro a descrever um mecanismo bioquímico que aumenta a atividade de uma molécula cuja presença é observada em muitos tipos de câncer. p A molécula, uma enzima chamada Pif1helicase, desempenha um papel em muitos processos celulares importantes no corpo. A regulação rígida dessa proteína é vital para a estabilidade do genoma porque pouca ou muita atividade pode influenciar o envelhecimento e doenças relacionadas à idade, principalmente câncer. Uma terapia comum contra o câncer, Inibidores de HDAC, também pode desencadear um pico nesta enzima.
p "Atualmente, estamos dando às pessoas medicamentos que aumentam a atividade Pif sem saber totalmente como isso afeta outras partes da célula que desempenham um papel na estabilidade do genoma, "disse Lata Balakrishnan, um professor associado de biologia na Escola de Ciências da IUPUI, que é co-autor principal do estudo.
p "Os inibidores de HDAC regulam positivamente certos genes de supressão de tumor, e, portanto, são usados em terapias de combinação para tratar cânceres específicos, mas quando se trata de seu impacto em outras partes da célula, estamos basicamente operando no escuro. "
p O outro autor principal do estudo é Matthew Bochman, professor associado do Departamento de Bioquímica Molecular e Celular da IU Bloomington College of Arts and Sciences. Outros co-autores são Christopher Sausen e Onyekachi E. Ononye, Ph.D. alunos nos laboratórios de Bochman e Balakrishnan, respectivamente, no momento do estudo.
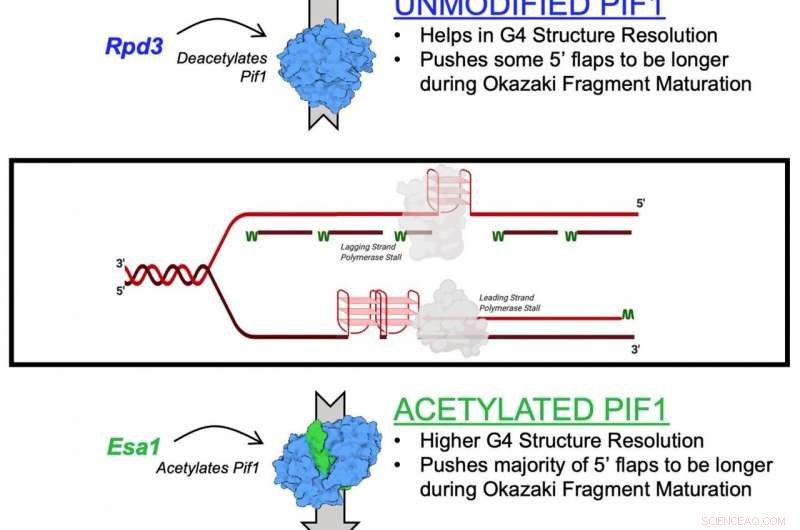
p O mecanismo descrito no estudo é o efeito da acetilação da lisina no Pif1. A acetilação da lisina ocorre quando uma pequena molécula chamada grupo acetil se liga à lisina, um aminoácido usado para construir proteínas comuns no corpo. Esta ação transforma a lisina de uma molécula com carga positiva em uma molécula com carga neutra. Esta neutralização pode afetar a função da proteína, estabilidade da proteína e interação proteína-proteína nas células, entre outras coisas.
p As helicases são conhecidas como "zíperes" genéticos das células porque separam o DNA para fins de replicação e reparo genético. Eles também ajudam a manter os telômeros, a estrutura no final dos cromossomos que encurtam à medida que as pessoas envelhecem.
p No novo estudo, os pesquisadores identificaram a acetilação da lisina na helicase Pif1 e mostraram que a adição do grupo acetil aumenta a atividade da proteína - bem como sua função de "descompactação". Eles também descobriram que a acetilação da lisina muda a forma - ou "conformação" - da proteína Pif1. Eles acreditam que essa mudança de forma aumenta a quantidade de helicase Pif1.
p "A interação dinâmica da adição e remoção do grupo acetil na lisina regula uma ampla variedade de proteínas dentro da célula, "Balakrishnan disse." Perturbações neste processo podem desempenhar um papel no câncer, envelhecimento, respostas inflamatórias e até mesmo comportamentos relacionados ao vício. "
p "Como uma classe, as helicases estão envolvidas em muitos processos necessários para a integridade do genoma, "Bochman acrescentou." Qualquer falha significativa nesses processos é geralmente cancerígena.
p Os detalhes precisos da acetilação da lisina em Pif1, seu efeito na forma da enzima e o impacto resultante na atividade da helicase levaram quase cinco anos para serem observados e relatados. O estudo, realizado em paralelo em dois campi IU, foi possível graças à experiência complementar dos principais cientistas. Como um bioquímico que já estudou a acetilação da lisina em outras proteínas, Balakrishnan foi capaz de isolar Pif1 in vitro para observar sua resposta a reações químicas em um tubo de ensaio. Em contraste, como geneticista trabalhando em leveduras como organismo modelo para estudar Pif1, Bochman foi capaz de modificar células in vivo para observar reações em um organismo vivo.
p "A capacidade de observar essas reações em uma célula viva é muitas vezes mais relevante, mas também é muito mais confuso, "Balakrishnan disse." Nossos experimentos estavam constantemente informando uns aos outros sobre aonde ir em seguida.
p Olhando para o futuro, Bochman disse que o conhecimento intrincado dos processos celulares - como a acetilação da lisina - desempenhará cada vez mais um papel na terapia personalizada.
p "Se você sequenciar o tumor de um paciente, você pode ajustar drogas para atingir enzimas muito específicas, "disse ele." Em vez de uma droga que afeta amplamente a célula inteira, será possível adotar uma abordagem direcionada que reduza os efeitos colaterais potenciais. Este nível de personalização é realmente o futuro da biologia e da medicina do câncer. "
